
在生命体系中,蛋白质可组装成高阶的结构以执行特定的生物功能,这些蛋白结构包括动态聚合物(肌动蛋白、微管蛋白等)、多维结构(细菌s层、胶原蛋白等)及完整的晶体(如质多角体病毒多面体)。这种生物组装过程激发了科学家们对蛋白质的新功能开发:即作为“构建模块”,设计具有非凡功能的生物纳米结构。基于计算机辅助的DNA-DNA互补配对和金属配位诱导的蛋白质组装技术在该领域取得了显著的进展。然而,由于蛋白质在形状和表面基团上固有的异质性,截至目前,只有极少数蛋白质可以通过上述技术组装出明确结构的材料体素。
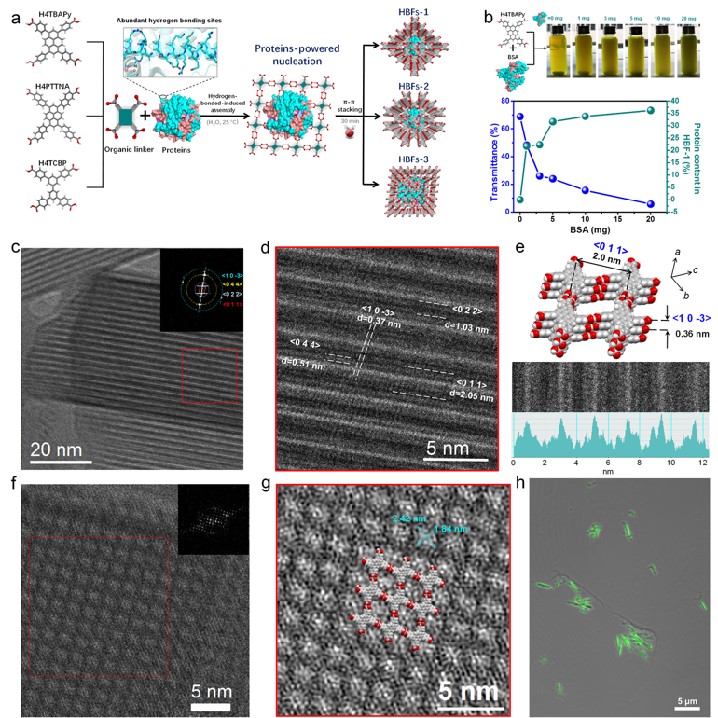
图1. 蛋白质导向的氢键组装策略及杂交框架的冷冻电镜结构
有鉴于此,我校化学学院陈国胜副教授和欧阳钢锋教授团队报道一种新的蛋白质导向组装策略 (图1)。在该策略中,蛋白质“模块”通过氢键作用锚定有机配体,并借助配体间的π-π作用组装成高度结晶的氢键生物杂交框架(Hydrogen-bonded biohybrid framework, HBF)。低电子剂量冷冻电镜技术在单分子水平上剖析了HBF的晶体学结构,并证明蛋白质在晶体框架中的单分散性。框架的蛋白质含量最高可达67.4%(W/W),是目前报道的最高数值。此外,HBF具有极高的化学稳定性,其孔径结构和蛋白质约束紧密度均可通过调节有机配体的结构进行合理控制。当用酶作为构筑“模块”时,得到的酶框架在酶加载量、结构稳定性和催化效率等多方面均比先前报道的酶@ZIFs体系有大幅度的提升。这项工作揭示了氢键组装策略在杂交框架设计的巨大潜力,在生物催化、传感和纳米医学等方面具有广阔的应用前景。该研究成果以“Protein-directed, hydrogen-bonded biohybrid framework”为题发表在CHEM上。文章的第一作者是化学学院陈国胜副教授和孙逸仙纪念医院黄思铭助理研究员,通讯作者是化学学院欧阳钢锋教授。
本研究得到国家自然科学基金、广东省自然科学基金和中央高校基本科研业务费等项目的资助;同时,获得中山大学测试中心、南方科技大学冷冻电镜中心和东南大学分析测试中心在相关测试方面的支持。