
富含鸟嘌呤的核酸序列可以形成非典型的G-四链体二级结构,普遍存在于人类端粒和基因启动子等具有重要生物学功能的区域中。近年来,G-四链体已经成为抗癌药物开发的潜在靶点。能够识别并选择性结合G-四链体的小分子化合物具有调节其相应基因表达的能力,具有抗肿瘤活性。然而,选择性G-四链体结合剂的开发仍然面临着巨大的挑战。常见的核酸G-四链体的靶向小分子的设计策略是设计含有大平面芳香基团的带正电荷的化合物。在结构水平上探索G-四链体与小分子的结合过程对其相互作用机制与功能调控研究至关重要,为合理设计小分子药物提供结构信息和理论基础。
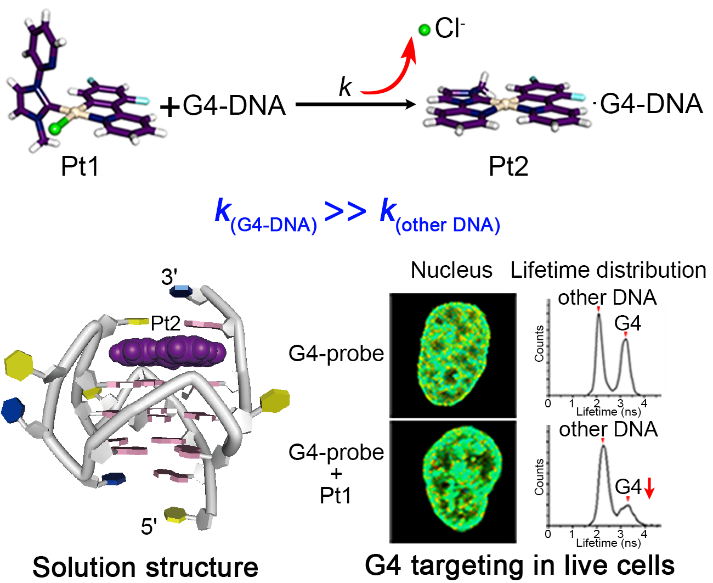
图1. Pt1选择性结合G-四链体DNA
近日,我校化学学院毛宗万教授团队报道了一例能通过时空控制选择性结合G-四链体DNA的铂配合物Pt1(图1)。NMR结构信息显示,Pt1在G-四链体DNA作用下配位Cl-水解、N-杂环卡宾配体自适应旋转,使Pt1转变成平面结构,激活与G-四链体DNA的相互匹配与结合,同时G-四链体DNA的结合位点发生了残基自适应重排。动力学研究表明,Pt1的Cl-离解速率是DNA结合的速率决定步骤,Pt1结合G-四链体DNA的Cl-离解速率比结合双链DNA和其自水解速率高2-3个数量级,从而在动力学速率上实现了Pt1对G-四链体的选择性。此外,团队成员利用G-四链体荧光寿命探针的竞争性试验证明了Pt1可以在活细胞的细胞核中靶向G-四链体DNA,并有效抑制VEGF的mRNA和蛋白的表达。同时,活体实验进一步表明,Pt1显著抑制斑马鱼血管的生长,达到有效的抗肿瘤效果。
毛宗万教授团队首次提出了一种新的G-四链体选择性靶向的时空控制策略,即由自适应结构转变激活小分子与核酸G-四链体的相互结合并由动力学控制小分子对G-四链体选择性。不同于传统的热力学控制模式,这种新的靶向模式由动力学控制,配合物的惰性配位键对选择性结合起调节作用,为G-四链体或其它生物分子的靶向小分子的开发与设计提供了新思路。
近日,该工作以通讯形式发表在化学顶级期刊《德国应用化学》上,题目为“Selectivity and Targeting of G-Quadruplex Binders Activated by Adaptive Binding and Controlled by Chemical Kinetics”Angew. Chem. Int. Ed. 2021, 60 (28), 15340-15343.
我校化学学院博士研究生朱博琛为论文的第一作者,刘文婷副研究员和毛宗万教授是该文章的通讯作者。该项研究工作得到了国家自然科学基金、教育部创新团队、广东省自然科学基金和中央高校基础研究经费等项目的资助。