
近日,我校医学院郭德银教授团队在国际知名期刊Proceedings of the National Academy of Sciences of the United States of America (PNAS)杂志在线发表了题为“An unconventional role of an ASB family protein in NF-κB activation and inflammatory response during microbial infection and colitis”的研究论文(Hou et al., 2021)。
炎症反应的精细调控对控制微生物感染和炎症性疾病至关重要。郭德银教授课题组发现ASB蛋白家族中的ASB1通过调节TAB2蛋白的稳定性促进其下游NF-κB和MAPK信号通路活性从而正向调控了炎症反应。且ASB1缺失的小鼠对细菌感染或细菌脂多糖(LPS)所诱导的脓毒症抵御能力增强,体内炎症反应降低,炎性细胞浸润和组织损伤减轻,存活率升高。此外,在葡聚糖硫酸钠(DSS)诱导的慢性炎症性肠炎模型中,ASB1缺失的小鼠的炎症反应也显著下降。这一发现对于理解炎症性疾病和制定与ASB家族蛋白相关的干预措施具有重要意义。博士后侯盼盼,博士生贾鹏辉和硕士生杨孔祥为论文共同第一作者,郭德银教授为通讯作者,我校医学院为第一完成单位。
NF-κB和MAPK依赖的信号通路对机体炎症反应具有重要作用。在信号转导过程中,TAB2/ TAB3作为TAK1复合体的一部分,与TRAF6或RIP1结合的K63多泛素链结合,激活NF-κB和JNK/p38信号通路,以此来响应TNFR或TLR的激活。然而,免疫反应和炎症反应在病原体感染条件下,尤其是炎症性疾病中的精细调控仍知之甚少。郭德银教授课题组利用CRISPR/Cas9第二代文库在免疫细胞中进行了全基因组水平的大规模无偏差筛选,发现了一系列参与天然免疫反应调控的新型基因。筛选系统中显示ASB1缺失后,病毒感染诱导的一型干扰素表达水平显著性下降。通过进一步研究,作者发现ASB1可正向调节NF-κB信号通路。该蛋白因子被认为是ECS E3泛素连接酶复合体中的底物识别蛋白,介导底物的K48型泛素化和随后的泛素-蛋白酶体途径依赖地降解。作者发现ASB1在LPS和细胞因子TNFα和IL-1β的刺激下表达增加,正反馈调节LPS和细胞因子诱导的NF-κB信号通路活性,无论是在细胞系还是小鼠原代细胞BMDM和BMDC中都显示了一致的现象。在生理水平上,ASB1缺失的小鼠对LPS和鼠伤寒沙门氏菌诱导的脓毒症反应减弱,对细菌和病毒的清除能力降低,这些结果表明ASB1通过调控NF-κB信号通路调控了机体的炎症反应。更有意思的是,ASB1缺失的小鼠对DSS诱导的炎症性肠炎的炎症反应减弱,体重减轻变慢,体内的炎症因子表达水平下降,小鼠存活率提高。这一结果表明ASB1在无外源感染的状态下也可以调控机体自身的炎症反应。在机制上,ASB1的ANK功能域介导其与NF-κB信号通路中的关键节点蛋白TAB2/TAB3相互作用,抑制了它们K48型的泛素化,促进了TAB2/TAB3的蛋白稳定性,从而增强了TAB2/TAB3/TAK1介导的NF-κB和MAPK信号通路的激活,进而正向调控了炎症反应。工作机制如下图。
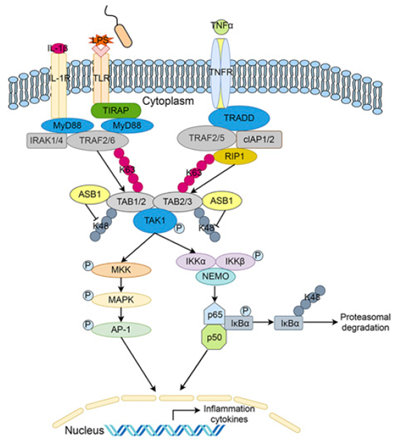
ASB1调控炎症反应的示意图
ASB蛋白属于SOCS超家族,ASB蛋白通过识别特定底物并介导底物的K48泛素化及随后的泛素-蛋白酶体途径依赖地降解来调节细胞因子信号通路和一些肿瘤相关通路。不同的是,该研究揭示了ASB1不同于其他含SOCS box蛋白的功能。它不仅抑制了底物TAB2的K48泛素化,反而促进了底物的稳定性。因此,该研究鉴定了ASB家族蛋白的一个不同于其他SOCS box成员的功能。以上这些结果说明,ASB1不仅可在免疫细胞中发挥调节炎症的作用,而且还在各种炎症性疾病模型中也具有同等重要的生理作用。鉴于这种重要作用,以ASB1为靶点设计药物可能在抗微生物感染免疫和炎症性疾病中具有重要意义。