
中大新闻网讯(通讯员张旭东)近日,中山大学医学院张旭东副教授课题组以“Engineered T cell extracellular vesicles displaying PD-1 boost anti-tumor immunity”为题在国际纳米材料领域顶级期刊Nano Today发表了基因工程编辑T细胞来源的细胞外囊泡用于肿瘤免疫治疗的研究成果。
近年来,肿瘤免疫治疗成为最具临床应用前景的抗肿瘤手段,尤其是免疫检查点阻断疗法。程序性细胞死亡蛋白1(Programmed cell death 1,PD-1)是T细胞表面的抑制性免疫检查点分子,与其配体PD-L1或PD-L2结合后抑制T细胞功能。肿瘤利用这一机制通过表达PD-L1与肿瘤特异性T细胞表面的PD-1结合,导致T细胞活化抑制且功能“耗竭”。为了恢复T细胞抗肿瘤能力,阻断PD-1/PD-L1通路是肿瘤免疫治疗的有效策略。然而,目前靶向PD-1或PD-L1的抗体疗法仍存在一定的局限性,如PD-1单抗药物在临床治疗中的总体响应率不高,且单一免疫疗法难以达到理想疗效。因此,需要进一步开发针对PD-1/PD-L1检查点的免疫疗法。
细胞外囊泡(Extracellular vesicles, EVs)是由细胞产生分泌的膜囊泡,EVs主要分为微泡(MVs)和外泌体(Exos)。EVs通过运输脂质,蛋白质和核酸介导体细胞间通讯,具有良好的循环稳定性、天然屏障穿透性和组织细胞靶向性,在癌症治疗和药物递送中具有广阔的应用前景。此外,EVs继承了其来源母细胞的特性,可发挥多种细胞生理和调节功能。来源于细胞毒性T细胞的EVs含有细胞毒性分子,包括穿孔素、颗粒酶、溶酶体酶和FasL等,具有诱导肿瘤细胞凋亡的潜力。然而,关于T细胞来源的EVs在肿瘤免疫治疗中的应用尚未完全被研究和开发。
基于此,张旭东副教授团队制备了过表达PD-1蛋白的细胞毒性T 细胞EVs,用于阻断肿瘤细胞与效应T细胞间的PD-1/PD-L1通路,并利用其细胞毒性分子辅助杀伤肿瘤,实现对肿瘤的免疫治疗。研究团队首先通过基因工程改造了T细胞系(CTLL-2),使其过表达PD-1受体蛋白,并通过差速离心获取其PD-1 EVs。这些EVs表达PD-1、FasL和GzmB等蛋白分子,可在体外与肿瘤细胞通过PD-1/PD-L1的相互作用而结合,并能够直接诱导肿瘤细胞凋亡(图1)。在荷瘤小鼠体内,PD-1 EVs可有效抑制肿瘤生长,提高肿瘤微环境中效应T细胞的增殖和活性,增强其抗肿瘤效应,有效延长小鼠生存期。该研究为免疫治疗提供了新的可选方法,拓宽了T细胞外囊泡在肿瘤免疫治疗中的应用前景。
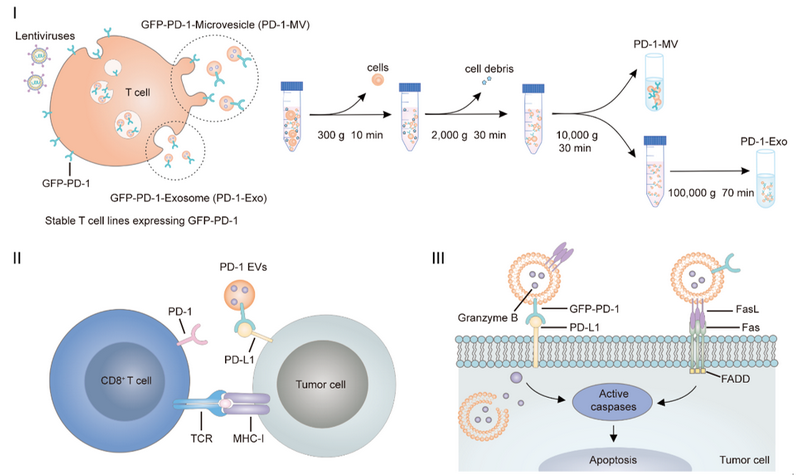
图1. PD-1-Exo和PD-1-MV的制备和作用机制示意图
Ⅰ. PD-1-Exo和PD-1-MV的制备;Ⅱ. PD-1 EVs阻断PD-1/PD-L1通路;TCR:T细胞受体,MHC-I:主要组织相容性复合体I;Ⅲ. PD-1 EVs诱导肿瘤细胞凋亡;FasL:Fas配体,FADD: Fas相关死亡结构域
该论文的第一完成单位为中山大学医学院。浙江大学药学院顾臻教授、中山大学医学院张旭东副教授和广东医科大学基础医学院梁欣博士为论文的共同通讯作者。共同第一作者为中山大学医学院研究生李宝琪、房湉靓和李园。这项工作得到了国家自然科学基金,广东省自然科学基金,深圳市优秀科技创新人才培养项目(优青项目),深圳市基础研究重点项目的支持。
论文链接:https://www.sciencedirect.com/science/article/abs/pii/S1748013222002341