
中大新闻网讯(通讯员邓冠军)2023年12月,中山大学药学院(深圳)的邓文斌教授团队在Advanced Functional Materials发表了题为“Engineered Microglia-Exosomes Coated Highly Twisting AIE Photothermal Agents to Efficiently Cross Blood-Brain-Barrier for Mild Photothermal-Immune Checkpoint Blockade Therapy in Glioblastoma”的文章。近年来,免疫检查点阻断疗法刷新了免疫治疗的效果,特别是对于肺癌、黑色素瘤等癌症的治疗,将五年生存率整体提高了三倍左右。然而,在胶质母细胞瘤的治疗中,免疫检查点阻断疗法的效果却非常有限。经各种研究分析发现,这一困境主要有三个原因:一是抗体等大分子药物难以穿透血脑屏障、靶向胶质母细胞瘤;二是肿瘤微环境中缺乏足够数量的预先存在的CD8+T细胞;三是化疗药物常常导致耐受性产生。
研究团队开发了一种外泌体药物递送平台,该平台能够跨越血脑屏障并特异性地靶向胶质母细胞瘤,研究团队通过基因工程的方法将免疫检查点抗体anti-LAG3表达在小胶质细胞外泌体上而制备了工程化小胶质细胞外泌体,同时将光敏剂载入表达anti-LAG3的工程化外泌体中而形成EE@Fs-NPs。由于工程化小胶质细胞外泌体膜上表达整合素蛋白VLA-4和LFA-1能够打开血脑屏障形成“绿色通道”,从而使EE@Fs-NPs顺利进入脑部。此外,工程化小胶质细胞外泌体使EE@Fs-NPs特异性靶向胶质母细胞瘤,因此,EE@Fs-NPs成功将免疫检查点阻断抗体和光热剂递送到肿瘤部位。免疫检查点阻断抗体anti-LAG3逆转T细胞耗竭状态,联合在激光照射下EE@Fs-NPs能产生温和光热治疗,提高胶质母细胞瘤对免疫检查点阻断疗法的响应度以及不会产生耐药性,实验表明温和光热-免疫联合治疗显著性提高胶质母细胞瘤的治疗效果。
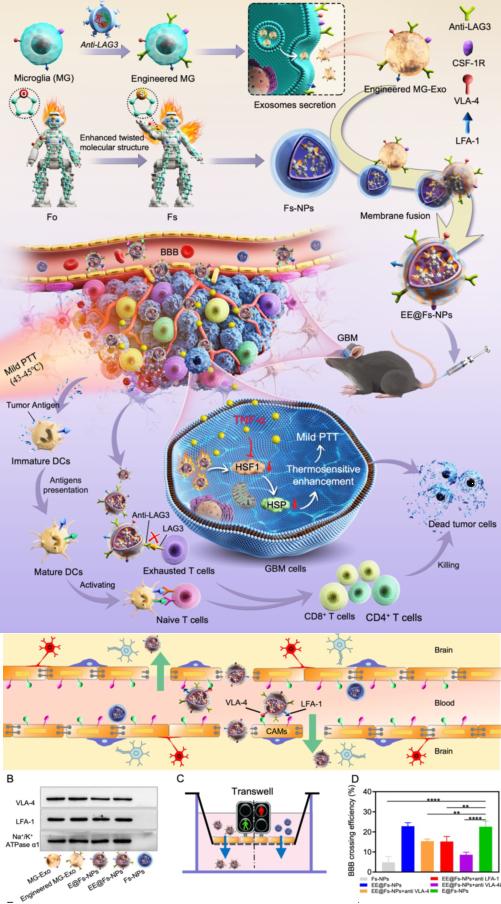
研究示意图
该研究揭示了工程化小胶质细胞外泌体作为脑部药物递送载体的独特优势,这种细胞外泌体能够跨越血脑屏障并具有高度的靶向性,使其成为一种非常有前景的工程化递送系统,基于工程化小胶质细胞外泌体的药物递送载体有潜力成为中枢神经系统疾病治疗的通用平台,为小分子药物以及大分子抗体的输送提供可行的解决方案。另外,EE@Fs-NPs介导的光热-免疫协同治疗平台可以有效应对化疗药物耐受性等问题,为存在耐药菌感染的患者提供创新的治疗模式。这一研究成果不仅为胶质母细胞瘤患者带来了希望,同时也有望在其他中枢神经系统疾病的治疗中发挥重要作用,如脑卒中、阿尔茨海默病等。研究团队对于该平台的未来临床应用前景充满信心,并期待这一研究成果能够为医学领域带来新的进展。
该论文的第一作者为中山大学药学院(深圳)博士研究生林珣,通讯作者为中山大学药学院(深圳)邓文斌教授和邓冠军副教授,中国科学院深圳先进技术研究院蔡林涛研究员。该研究得到了国家自然科学基金,广东省自然科学基金等项目支持。
论文链接:https://doi.org/10.1002/adfm.202310237