
中大新闻网讯(通讯员程芳)近期,中山大学药学院(深圳)的程芳、陈红波教授团队利用CRISPR/Cas9遗传文库筛选平台发现肿瘤细胞调节内源性PD-L1表达的一条新通路,为肿瘤免疫治疗提供了一个潜力靶点TRAF6,并验证了该靶点的抑制剂硼替佐米对恶性黑色素瘤的治疗潜力。该研究基于团队建立的应激与蛋白稳态CRISPR/Cas9文库高通量筛选文库,结合TMT-定量蛋白组学结果,与临床样品数据进行交互分析,筛选并确定E3泛素连接酶TRAF6是PD-L1的关键上游调节因子,并阐明TRAF6通过K63多聚泛素化修饰新位点YAP1K497,增强YAP1的稳定性,促进YAP1的核定位,并提高YAP1/TFCP2复合物对PD-L1转录增强作用。同时,该研究验证了TRAF6抑制剂硼替佐米(Bortezomib)对恶性黑色素瘤肺转移的治疗作用及对肿瘤浸润免疫细胞的激活作用。特别地,硼替佐米增强抗肿瘤免疫的程度,能与PD-1单克隆抗体疗法相媲美,且对于小鼠淋巴结、脾脏的免疫功能无明显副作用。本研究开拓了临床治疗多发性骨髓瘤的一线靶向药物硼替佐米的新应用场景,实现该药物的“老药新用”。
中山大学药学院(深圳)博士研究生王凌璐和2018级硕士研究生刘晓燕为这项研究的共同第一作者,程芳教授、陈红波教授及江苏大学附属医院朱海涛教授为共同通讯作者 (Cancer Letters, 2024, IF=9.2,中科院1区)。该工作得到了国家自然科学基金、广东省国际科技合作项目和广东省消化系统恶性肿瘤防治研究重点实验室等多个项目的支持。
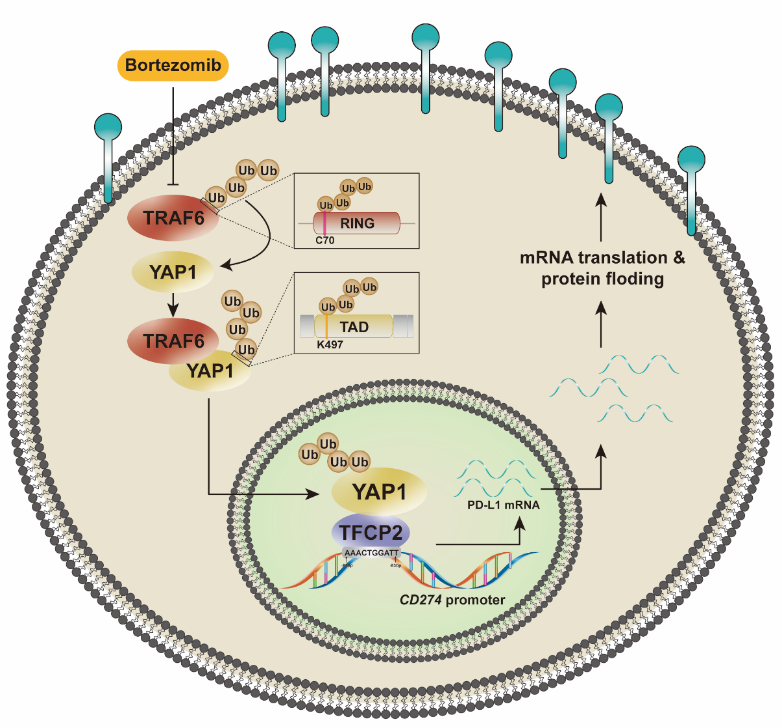
TRAF6/YAP1-TFCP2/PD-L1作用机制图
同时,近期该团队还基于CRISPR/Cas9高通量代谢文库筛选技术平台和PDX模型,发现支链氨基酸转移酶2(BCAT2)调控肿瘤细胞铁死亡抵抗的机制,即铁自噬-AMPK-SREBP1途径增强BCAT2转录和酶活性,促进内源性谷氨酸合成增加,降低脂质过氧化水平,引起肝癌和胰腺癌铁死亡抵抗,并拓展了肠道“老药”柳氮磺嘧啶的新用途,发现其联合索拉非尼,抑制肿瘤中BCAT2表达,并显著提升对耐药难治性肝癌和胰腺癌的治疗效果 (Cell Death and Differentiation, 2021, IF=13.7,中科院1区)。团队还设计了靶向肝癌铁死亡的外泌体样囊泡修饰策略,将分泌的转铁蛋白通过一个锚定序列固定表达在膜上,制备成纳米囊泡,包载铁死亡诱导剂索拉非尼,通过膜上的转铁蛋白受体介导的内吞作用进入肝癌细胞,被裂解后释放出索拉菲尼和脂质合成原料铁离子,协同加快脂质过氧化物的积累,导致铁死亡。体外和体内实验都证明,此策略能成功诱导肝癌细胞铁死亡,并且显著抑制皮下瘤和原位肝癌生长 (Biomaterials Research, 2023, IF=15.8)。该工作获得2023年度江苏省科学技术奖三等奖。
目前临床上主要利用高剂量阿糖胞苷治疗复发难治性白血病,然而很多患者因为副作用而放弃治疗。为了鉴定低剂量阿糖胞苷联合致死靶点,本团队联合清华大学和南方医科大学珠江医院血液科利用CRISPR/gRNA遗传文库技术进行了筛选,并鉴定到PHF6是关键联合致死靶点。PHF6 突变见于16%的儿童和38%的成人T-ALL患者,然而还没有针对PHF6突变型白血病的精准治疗方案。首先通过临床回顾性调查,发现PHF6突变的白血病患者对阿糖胞苷等常用化疗药物耐药(Cancer Med. 2022 Sep 29. doi:10.1002/cam4.5173)。进一步团队揭示PHF6是一种重要的组蛋白甲基化(修饰)密码解读器,可以识别和结合核仁区域染色质组蛋白上的H3K9me3和H3K27me1,并将组蛋白甲基转移酶SUV39H1招募到核仁中,维持核仁rDNA基因座位染色质的异染色质状态,从而抑制rDNA基因的转录和核糖体的组装。PHF6临床突变体的核仁定位,识别和结合H3K9me3,以及招募SUV39H1的能力降低,导致rDNA转录活性增加、体外白血病细胞增殖和体内小鼠白血病异种移植物生长。更重要的是,在PHF6突变的临床AML患者样本中也观察到rRNA前体分子的表达水平显著升高,进一步证明了体外研究结果。进一步,发现一个rDNA特异性转录抑制剂CX5461能够显著降低PHF6功能缺失的U937 AML细胞对阿糖胞苷的耐药性。此研究发表在Acta Pharmaceutica Sinica B,2022,IF=14.5,中科院1区。该工作得到了国家自然科学基金、广东省自然科学基金和深圳市学科布局项目的资助。
此外,本团队依托中山大学药学院(深圳),还成功建立了规模化外泌体/细胞膜纳米囊泡制备和应用平台,并开展了其在肿瘤精准治疗领域的系列应用研究:1)设计表面展示BCMA的细胞外纳米囊泡,靶向中和微环境中过量的促癌因子APRIL与BAFF,增进多发性骨髓瘤对硼替佐米的敏感性,降低药物的毒副作用 (Acta Biomater, 2022, IF=10.6); 2)构建表达CD64的纳米囊泡偶联PD-1抗体,阻止T细胞耗竭,增强免疫治疗效果(Theranostics,2021,IF=11.6);3)设计负载吉西他滨的过表达PD-1的纳米囊泡,显著抑制了乳腺癌的增殖 (Pharmaceutics, 2022, IF=6.5)。这些研究成果为基于治疗新靶点来开发靶向药物以实现多重治疗效应提供了新的策略。
论文链接: https://doi.org/10.1016/j.canlet.2024.216861