
中大新闻网讯(通讯员王海河)近日,中山医学院王海河教授团队、中山大学附属第一医院杨蜀岚研究员团队合作在Autophagy (2020 IF:16.016)发表题“Adaptor SH3BGRL drivesautophagy-mediated chemoresistance through promoting PIK3C3 translation andATG12 stability in breast cancers”的研究论文,该研究揭示了一个小分子接头蛋白SH3BGRL可以通过结合核糖体蛋白促进自噬相关基因的蛋白翻译效率,从而促进乳腺癌细胞的中度自噬而导致乳腺癌细胞对化疗耐药的机制。
细胞通过自噬可以降解细胞内长寿命蛋白、蛋白聚合物以及受损细胞器来调控和维持细胞的稳态,它还可以通过限制炎症、清除有毒的未折叠蛋白,除去生成活性氧簇(可损害DNA)的受损线粒体来抑制肿瘤早期形成。一旦失去这种保护性措施将促使癌症发生,肿瘤细胞中的适度自噬往往促进肿瘤细胞的存活和抗逆功能,进而导致肿瘤细胞耐药,由此说明细胞自噬在肿瘤发生、发展过程中具有两面性。目前,对于肿瘤细胞中所存在的内在的自噬发生机制或者直接的驱动基因仍然还很不清楚。
在这项研究工作中,研究团队首先基于临床样本分析发现SH3BGRL无论是在RNA水平还是蛋白水平在高达40-60%的乳腺癌样本中高表达,而且与患者的不良预后和化疗耐药相关。基于SH3BGRL是一个简单的接头蛋白特征,研究者通过蛋白互作的质谱分析发现SH3BGRL在肿瘤组织样品和细胞中均可以结合大量核糖体亚基蛋白,进而通过多聚核糖体谱(poly-ribosome profiling)结合RNA测序分析发现,SH3BGRL表达变化可以引起普遍的mRNA翻译效率改变;研究进一步发现,在翻译改变的基因当中,与自噬起始相关基因PIK3C3的翻译效率急剧增加。此外,SH3BGRL还可以结合另一个自噬起始基因相关蛋白ATG12,抑制其泛素化降解,从而促进了肿瘤细胞的自噬水平。当在SH3BGRL过表达的细胞中通过敲除PIK3C3或ATG12可以阻止SH3BGRL引起的细胞自噬以及肿瘤细胞对doxorubicin等化疗药物的耐药性;而敲降SH3BGRL可以降低细胞的自噬水平,增加对这些化疗药物的敏感性。
本研究首次证实一个小分子连接蛋白可以通过结合到核糖体复合物来调节核糖体对mRNA翻译的效率特性而促进肿瘤细胞中与肿瘤细胞自噬发生相关基因在翻译水平上的上调表达,为进一步研究核糖体构成(组成)蛋白对mRNA翻译的选择性提供了前期基础,并解析了乳腺癌细胞内在的化疗耐药机制,为克服先天性肿瘤细胞耐药提供了潜在的检测和治疗药物靶点(图释)。
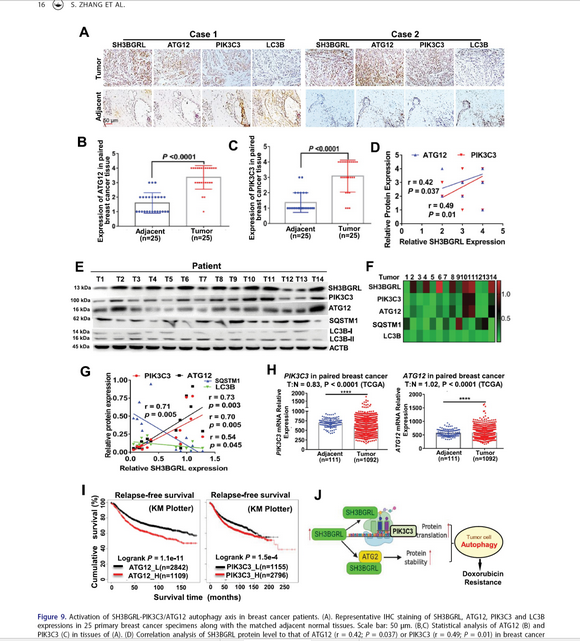
图:SH3BGRL-PIK3C3/ATG12通路活化导致乳腺癌细胞化疗耐药的机制
同样地,研究团队还揭示该小分子接头蛋白SH3BGRL在翻译水平上抑制肿瘤细胞粘附蛋白PFN1在翻译水平上的表达,从而促进肿瘤细胞转移的特性(Oncogene,2021,Sep; 40(38): 5677-5690;2020 IF:9.867);他们还发现SH3BGRL可以和乳腺癌细胞膜上的HER2蛋白受体结合,从而不依赖生长因子激活并稳定细胞膜上的HER2引起HER2靶向治疗的先天性耐药(J Exp Clin Cancer Res. 2020 May 7;39(1):81;2020 IF:11.161)。
中山大学附属第一医院和中山大学中山医学院联合培养的博士研究生张邵阳为本研究的第一作者,中山大学附属第一医院转化医学中心杨蜀岚研究员和中山大学中山医学院王海河教授为本文的共同通讯作者。本工作得到了国家自然科学基金和广东省自然科学基金项目支持,同时得到教育部组织工程与干细胞科研平台的大力支持。