
近日,我校生命科学学院崔隽教授和王荣福教授课题组发现了抗病毒免疫中的关键激酶TBK1的一个重要的泛素化调节信号复合物NLRP4-USP38-DTX4/TRIP,通过动态调控TBK1的稳定性,维持抗病毒反应中的免疫平衡。该成果以“USP38 Inhibits Type I Interferon Signaling by Editing TBK1 Ubiquitination through NLRP4 Signalosome”为题,发表在近期的《Molecular Cell》杂志上。中山大学为第一完成单位,中山大学生命科学学院博士研究生林萌、赵芝瑶同学和中山医学院硕士研究生阳智芬同学为该论文共同第一作者。该研究受到国家自然科学基金委“优秀青年基金”、国家重点基础研究计划青年科学家专项、广东省自然科学杰出青年基金及广东省创新团队等项目的支持。
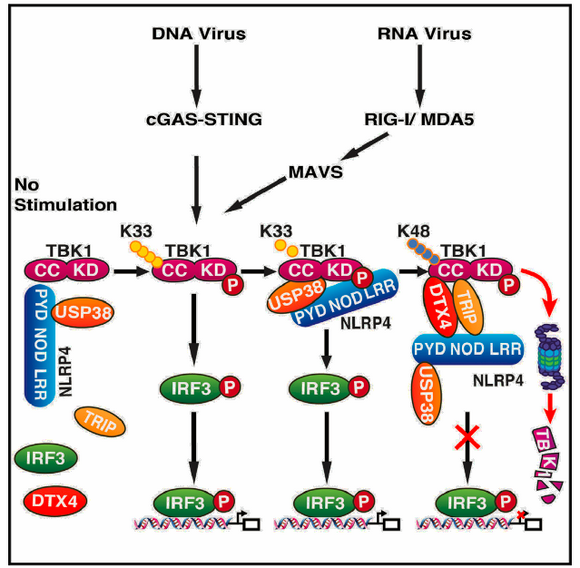
图1:NLRP4信号小体调控TBK1稳定性的工作模型(引自Mol Cell. 2016 Oct 20;64(2):267-281.)。
当人体面对病毒入侵时,天然免疫系统承担了第一道防线的作用。大多数的天然免疫细胞采用了TBK1-IRF3信号通路以最终促进干扰素的合成。其中,TBK1激酶是活化IRF3的关键激酶,其本身受到磷酸化和泛素化等翻译后修饰调节。研究者们发现,去泛素酶USP38分子可显著下调抗病毒反应的强度。USP38可激发蛋白酶体介导的TBK1降解。当USP38基因被敲除后,小鼠的抗病毒反应会变得异常剧烈。进一步的实验显示,USP38会切除从TBK1的K670位点上延伸出的K33多聚泛素链,从而使之得以“让位”于同样从K670位点开始的介导TBK1降解的K48多聚泛素链。
崔隽教授和王荣福教授之前的工作已显示,K48连接的泛素化修饰可导致TBK1的降解。当模式识别受体NLRP4被激活后,其可招募泛素连接酶DTX4或TRIP,使其对TBK1的K670位点进行K48泛素化修饰(Nature Immunology, 2012)。在本研究中,NLRP4被发现同样介导了USP38对TBK1的去泛素化作用。在体外实验中,研究者们发现293T细胞在暴露于水泡性口炎病毒(VSV)六小时后,NLRP4和USP38便会开始作用于TBK1,而在又过了两小时后,DTX4和TRIP才会与TBK1作用。 根据此发现,研究者们提出:NLRP4-USP38-DTX4/TRIP构成了一个以NLRP4为中心的“信号体”,共同决定着TBK1的稳定性。TBK1是天然免疫细胞抗病毒信号通路的一个中心节点,同时接受着来自RLR、cGAS等多种模式识别受体的激发信号,以促进干扰素合成等一系列抗病毒反应。如果这一过程不受控制,则可能造成反应过度的后果,导致自体免疫疾病和慢性炎症等疾病。因此,NLRP4-USP38-DTX4/TRIP“信号体”对上述反应起着“刹车”的作用,以维持抗病毒反应中的免疫平衡。