
中大新闻网讯(通讯员刘峰)DNA双链断裂 (DNA double-strand break, DSB) 是一种常见且高度有害的DNA损伤形式,其缺陷或失调与肿瘤、衰老以及免疫缺陷等密切相关。非同源末端连接(Non-homolouous end joining, NHEJ)和同源重组(Homologous recombination, HR)是DSB修复的两条主要通路。对于富含重复序列的异染色质来说,HR修复则容易造成非等位基因间的同源重组(non-allelic homologous recombination, NAHR),从而导致染色体的重排与畸变。因此,细胞如何调控和选择这两种途径对DNA修复的精确性以及基因组稳定性的维持至关重要。PARP抑制剂(PARPi)是临床上治疗BRCA突变乳腺癌和卵巢癌的一线靶向药物,如果肿瘤细胞中NHEJ的某些关键调控因子如53BP1、RIF1等发生缺失或突变,则会导致HR通路重新激活,从而引起对PARPi的抗药性。利用这个特性,可以通过全基因组水平的PARPi耐药筛选,寻找一些能调控NHEJ/HR修复通路选择且未知的NHEJ调控因子。
2023年6月15日,中山大学生命科学学院的松阳洲课题组与孙逸仙纪念医院合作在Nature Cell Biology杂志长文发表了题为“Transmembrane nuclease NUMEN/ENDOD1 regulates DNA repair pathway choice at the nuclear periphery”的研究成果。该研究利用CRISPR筛选,首次报道了核膜锚定的核酸酶NUMEN/ENDOD1参与NHEJ修复通路,并通过特异性切割3’垂悬DNA(3’overhang DNA)调控NHEJ/HR通路的选择。NUMEN的核膜定位为核周分布的LADs进行NHEJ修复创造了条件,有利于基因组稳定性的维持。另外,NUMEN的缺失也会导致BRCA1突变的肿瘤细胞对PARPi产生耐药。NUMEN的发现解释了细胞如何根据不同染色质状态以及核内空间分布选择最有利的DSB修复方式,以最大程度维持基因组的稳定性。
研究人员首先通过全基因组的CRISPR敲除筛选,得到一系列可造成PARPi耐药的候选基因,其中包括已知的耐药基因如53BP1、RNF168与SLFN11等,证明了筛选结果的可靠性。其中,ENDOD1作为一个潜在的核酸酶,在筛选结果中排名靠前且在DNA损伤修复中的作用几乎未见报道。基于本研究中发现ENDOD1的一些新特征,研究人员将其重新命名为NUMEN(Nuclear membrane endo/exonuclease)。
研究人员接着验证了NUMEN缺失也可导致肿瘤细胞对多种DNA损伤药物更为敏感,发现NUMEN同时具有核酸内切酶和3’→5’外切酶活性,能特异切割ssDNA以及3’overhang DNA,产生1-4 nt 5’overhang末端,推测NUMEN参与细胞内NHEJ修复的过程。
进一步,研究人员确认NUMEN敲除可以使细胞核内3’ overhang DNA累积增加,HR总体水平升高,NHEJ通路受到破坏;过表达NUMEN则有相反的效果,从而证实了NUMEN可以促进NHEJ并抑制HR修复,通过拮抗3’overhang形成参与调控DNA双链损伤修复途径的选择。随后,利用邻近蛋白标记技术(BioID),研究人员进一步鉴定了NUMEN的相互作用蛋白组,确定了其核膜定位的生物学意义,发现NUMEN敲除导致LADs上的DSB修复效率显著变慢。
最后,研究人员通过分析TCGA数据库发现,NUMEN低表达的乳腺癌样本中,与基因组瘢痕(Genomic Scar)相关的几种特征都有所升高;而且NUMEN表达水平与多种肿瘤的基因组拷贝数变异(CNV)呈显著负相关。这提示NUMEN对基因组稳定性的维持起着重要的作用。
综上所述,该研究揭示了NUMEN作为一个新发现的核膜锚定核酸酶,可以对DSB末端和3’overhang DNA进行切割,产生有利于NHEJ修复的底物,并调控NHEJ/HR通路的选择。NUMEN的核膜定位促进了LADs进行NHEJ修复,有助于基因组稳定性的维持。
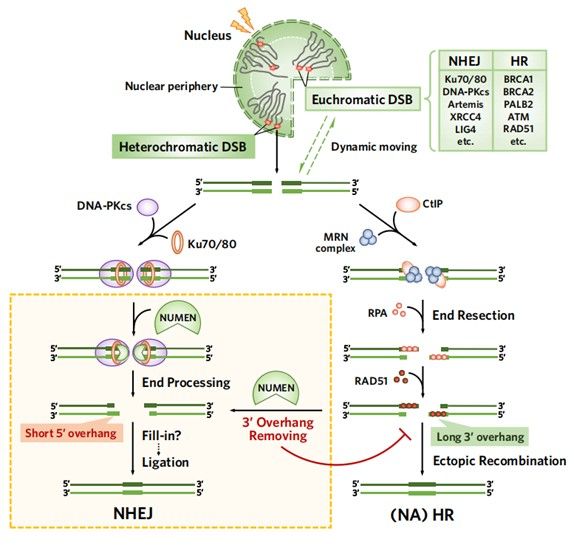
NUMEN的作用机制模型
松阳洲教授为该论文的通讯作者,陈柏洪博士以及博士研究生葛天宇为论文的共同第一作者。中山大学生命科学学院为第一署名单位。
Nature Cell Biology杂志在同期配发题为“Guiding DNA repair at the nuclear periphery”的专评,指出该工作对研究核周的DNA损伤修复通路选择以及HRD癌症的治疗具有重要意义。