
中大新闻网讯(通讯员肖洪)近日,中山大学附属第三医院纳米医学中心帅心涛教授团队联合超声科任杰教授团队,在生物材料著名期刊Acta Biomaterialia(IF = 10.633)发表题为“Sono-promoted drug penetration and extracellular matrix modulation potentiate sonodynamic therapy of pancreatic ductal adenocarcinoma”的研究成果。研究针对胰腺癌致密的基质环境造成药物分子难以在肿瘤组织有效渗透导致其治疗困难的临床问题,研发了一种超声响应性聚合物全氟化碳纳米液滴,结合外源性超声刺激和内源性胞外基质调控,用以克服胰腺癌生理屏障,促进药物在胰腺癌肿瘤组织中的渗透,实现胰腺癌的高效治疗。
胰腺癌是最恶性的胃肠道肿瘤之一,其中90%以上为腺管上皮来源的胰腺导管腺癌(PDAC),其5年总生存率低于10%。PDAC治疗失败的一个主要原因是化疗药物难以渗透进PDAC致密的肿瘤基质。研究表明,致密的胞外基质(ECM)不仅支持肿瘤的发生、发展、侵袭和转移,而且与PDAC的耐药性和免疫逃逸有关。鉴于PDAC存在的特殊ECM环境,因此提高化疗药物的渗透性对提高PDAC的治疗至关重要。胰腺星状细胞(PSCs)是一种特殊的胰腺基质细胞,平时处于静默状态,在正常胰腺组织中约占4%。然而,在胰腺组织出现机械或病理性损伤等应激条件下,PSCs会被激活成肌成纤维细胞表型,成为高度增殖的细胞。活化的PSCs会产生大量的ECM成分,比如胶原蛋白、纤维连接蛋白、糖蛋白、基质金属蛋白酶和细胞因子等等。清除ECM的策略显示出了有效增强化疗药物肿瘤治疗效果的作用。因此,将活化的PSCs转变为静默状态,以恢复PDAC基质稳态,可能是提高治疗PDAC效果的有效途径。然而,作用于PSCs的药物如何跨越PDAC中已经建立的ECM屏障,是一个巨大的挑战。
目前,相关研究提出了一些提高药物在肿瘤组织中渗透的策略,包括细胞穿透肽(CPP)修饰、形貌可变的纳米药物、ECM调控以及外源性机械刺激。其中,外源性机械刺激具有操作简单、成本低、临床转化前景好等优点,被认为是提高药物渗透性最直接的手段。超声作为其中一种,是一种安全且临床应用广泛的技术,由于其良好的组织穿透性、无创性、以及对促进药物渗透的作用,在肿瘤成像和治疗方面得到了广泛的研究。因此,基于一种超声介导的治疗技术——“声动力治疗(SDT)”,也引起了人们的广泛关注,并成为癌症治疗的新手段。在SDT中,超声波不仅用于促进声敏剂的渗透,还用于激发其产生活性氧(ROS)杀死癌细胞。然而,SDT也是一个类似光动力治疗(PDT)的耗氧过程,肿瘤组织的缺氧环境严重限制了ROS的产生,导致其治疗效果不理想。多种克服肿瘤缺氧的策略,包括提高肿瘤组织含氧量或开发缺氧激活药物,被广泛的研究以提高氧依赖性的SDT和PDT的治疗效果。而给予外源性氧以增加肿瘤组织的氧水平是最直接的途径。全氟己烷(PFH)是一种对氧气(O2)具有高亲和力的、具有良好生物相容性的化学物质,在临床中已被用作人工血液替代品和超声成像造影剂。PFH作为缓解肿瘤缺氧重要的O2递送媒介已被广泛研究。然而,PFH的高疏水性导致其体内半衰期短,无法在肿瘤组织中有效富集。值得注意的是,有报道称氟烷修饰材料可以提高PFH的体内稳定性,因为氟烷片段与PFH分子结构相似,可以嵌入PFH液滴中。
因此,研究团队开发了一种超声响应聚合物全氟己烷(PFH)纳米液滴(简称MA-CPPNDs@O2),通过结合外源性超声刺激和内源性ECM调节,促进药物在胰腺癌组织中的深层次渗透,用于胰腺癌的高效声动力治疗。该纳米液滴由氟烷烃改性聚合物mPEG-PAsp(BZA-co-MEA)-C6F13,与全反式维甲酸(ATRA)、锰卟啉(MnPpIX)和富氧的PFH自组装形成。在超声(US)照射下,纳米液滴会迅速气化并产生空化力,促进负载药物从纳米液滴中快速释放并在胰腺癌组织中深层渗透。此时,渗透良好的ATRA有效抑制基质细胞PSCs分泌ECM蛋白组分,降低胰腺癌肿瘤基质密度,形成有利于药物扩散的非致密性微环境。同时,超声激活声敏剂MnPpIX产生大量的活性氧,发挥SDT效应。利用PFH作为O2的输送介质,纳米液滴还可以有效缓解肿瘤组织的乏氧情况,增强SDT肿瘤杀伤作用。因此,该纳米液滴有效抑制了胰腺癌肿瘤的生长,并有望为PDAC治疗提供一种新的策略。
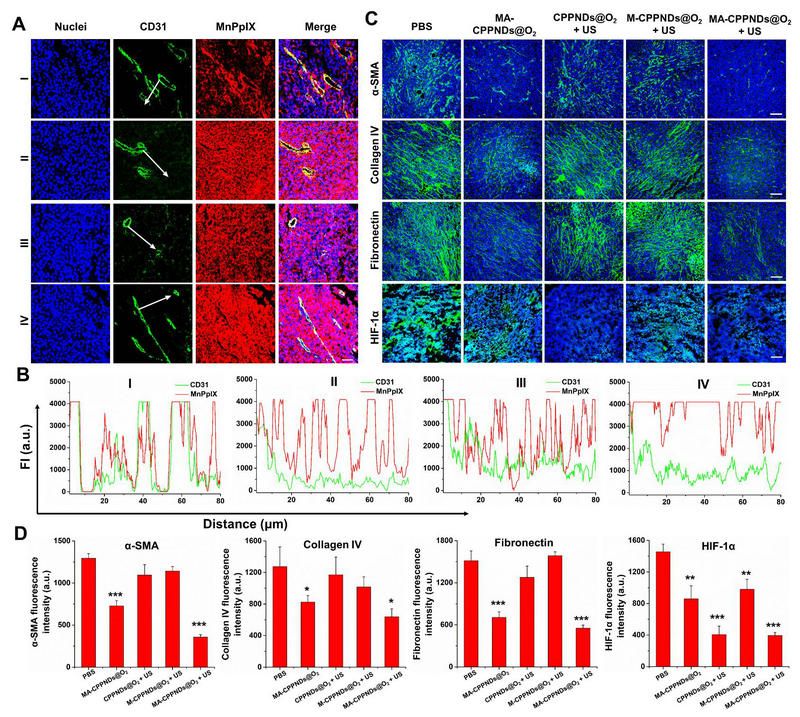
图 超声响应聚合物PFH纳米液滴用于PDAC的声动力治疗。(A)超声刺激或ECM重塑后,药物在肿瘤组织中的渗透。I:未处理组;II:超声处理组;III:ECM重塑组;IV:超声刺激加ECM重塑组。(B)MnPpIX荧光强度与CD31标记的肿瘤血管距离的定量分析。(C)纳米药物治疗后PDAC肿瘤组织中ECM调节情况和乏氧缓解情况。(D)治疗后对的肿瘤组织中α-SMA、IV型胶原、纤维连接蛋白和HIF-1α的荧光强度的半定量分析。
研究论文第一作者为中山大学附属第三医院超声科博士后肖洪,通讯作者为中山大学附属第三医院帅心涛教授、任杰教授及珠海市人民医院韩世松副研究员。
论文链接:https://doi.org/10.1016/j.actbio.2023.02.038