
中大新闻网讯(通讯员李咸君、姜鑫)2022年全国癌症报告显示,我国肺癌每年新发病人数约为82.8万,死亡病例数约71万,位居恶性肿瘤发病率与死亡率的首位。肺癌进展十分迅速,很多人确诊时已经到了中晚期,而有限的治疗手段,使晚期肺癌患者生存率并不理想。作为最具前景的免疫治疗方式之一,CAR-T疗法(嵌合抗原受体T细胞疗法)在血液肿瘤治疗中取得了显著成功,但因肿瘤中的免疫微环境对CAR-T细胞具有明显的抑制作用,导致该疗法在肺癌等实体瘤治疗领域的前景尚不明朗。因此,如何提高CAR-T细胞在实体瘤中疗效至关重要。
近日,中山大学附属第五医院外科主任兼胸外科主任曹庆东教授团队和学术总监黄曦教授团队在国际权威期刊Advanced Materials上发表题为“Genetically Programmable Vesicles for Enhancing CAR-T Therapy against Solid Tumors”的科研成果。曹庆东教授、黄曦教授为文章共同通讯作者,胸外科在读博士李咸君为文章第一作者。
该研究开发了一种能增强CAR-T细胞治疗实体瘤功效的潜在药物——多功能基因重编程细胞囊泡(D@aPD-L1 NVs),该药物通过负载谷氨酰胺拮抗剂以改善抑制性的肿瘤微环境达到增强CAR-T细胞在肺癌中的治疗效果,具有良好的临床转化潜力和应用前景,对进一步的临床应用具有重要的指导和借鉴意义,为肺癌领域的治疗提供了一种新的策略选择手段。该成果已申请相关专利。
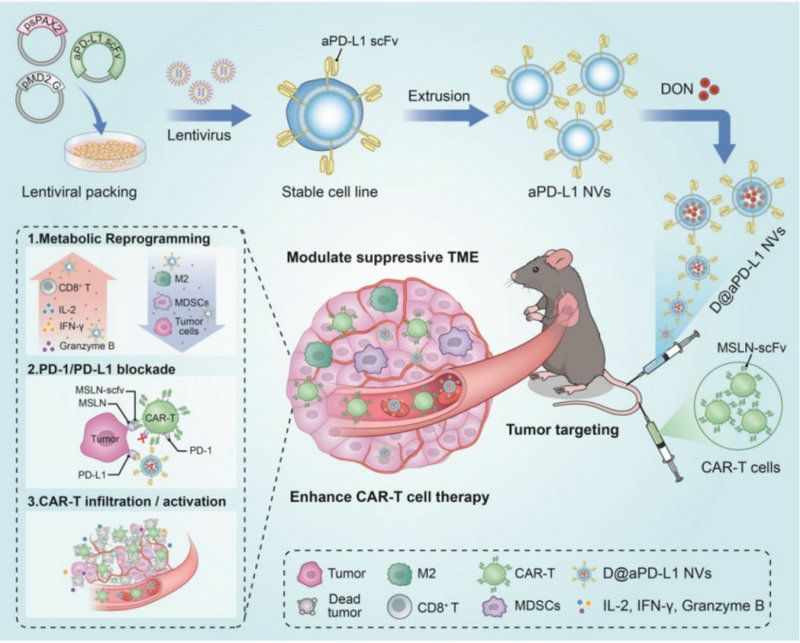
D@aPD-L1 NVs增强CAR-T细胞在实体瘤中治疗效果的示意图
这种通过基因工程改造的细胞囊泡表面因表达有高亲和力的PD-L1抗体,能与肿瘤表面的PD-L1抗原发生特异性结合,一方面具有良好的肿瘤靶向性,能将药物靶向递送到肿瘤部位,避免了谷氨酰胺拮抗剂治疗过程中的毒副作用;另一方面,细胞囊泡表面的PD-L1抗体可有效阻断PD-1/PD-L1抑制性信号,能有效解决CAR-T细胞治疗过程中引起的肿瘤细胞表面PD-L1上调,避免了CAR-T细胞过早发生耗竭,进而起到更好的杀伤肿瘤效果。更重要的是,D@aPD-L1 NVs有效减少了肿瘤微环境中免疫抑制细胞的数量,促进了肿瘤组织中炎性细胞的募集和炎性细胞因子的分泌。
上述特性使该药物改善了肺部肿瘤组织中CAR-T细胞的浸润和效应功能,最终增强了CAR-T细胞的抗肿瘤及长期记忆免疫能力。研究进一步表明,D@aPD-L1 NVs作为一种有前景的药物,能增强CAR-T细胞对肺癌的疗效,并且细胞源性囊泡具有良好的生物相容性,在既往的临床研究中已显示出其作为药物递送系统的安全性和有效性。
论文链接:https://pubmed.ncbi.nlm.nih.gov/36814099/