
干眼(DED)发病率高达21-30%,其主要症状包括眼干涩、疲劳、疼痛、流泪、异物感、烧灼感等诸多眼部不适,影响患者的工作和生活;严重病变还可引起角膜变薄、溃疡、瘢痕形成、甚至穿孔,危及患者视力、甚至盲目。干燥压力(DS)和渗透压过高等环境因素会影响刺激角膜上皮,从而诱发DED中的眼表免疫炎症损伤,因此,DED其实是一种多因素诱发的自身免疫性眼表疾病。但是上皮细胞与环境压力之间潜在的免疫损伤机制依然不明确。
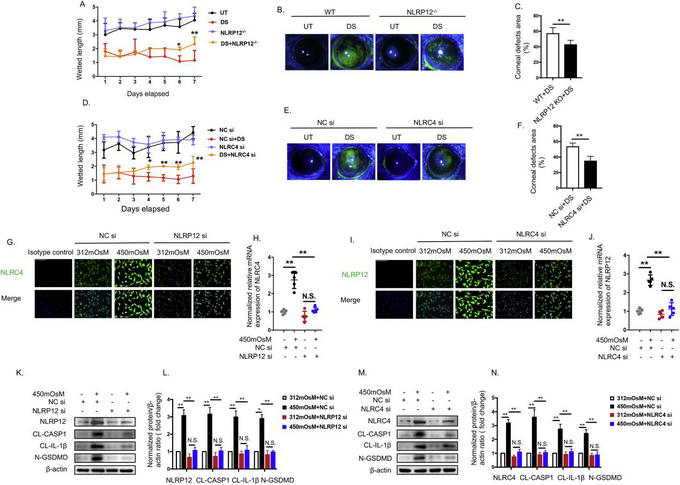
为解答这一重要科学问题,我校中山眼科中心迟玮副主任医师团队构建了小鼠和人角膜上皮细胞的干眼模型来模拟干燥和高渗压力诱导的干眼,深入研究干眼的免疫损伤机制和关键致病靶点。国际上首次发现环境压力可以促进角膜上皮细胞中的新型炎性小体——NLRC4和NLRP12炎症小体的组装、活化,从而诱导GSDMD的切割,引起角膜上皮的焦亡打孔、并伴随大量炎症因子(白介素[IL]-1β和IL-33)的释放;并且NLRC4和NLRP12可以相互协同放大焦亡的炎症损伤。研究还首先报道了细胞焦亡的新机制,即焦亡打孔的过程中不仅有经典的IL-1β的分泌还伴有大量IL-33释放,介导角膜上皮细胞的炎症损伤。靶向性调控GSDMD和IL-33的切割、活化可以显著抑制眼表组织损伤,证实了其是介导干眼发病的关键致病靶点。研究不仅揭示了干眼角膜上皮细胞免疫炎症损伤的关键机制,也为干眼的治疗提供了新靶点和治疗策略。近日,研究论文“NLRP12- and NLRC4-mediated corneal epithelial pyroptosis is driven by GSDMD cleavage accompanied by IL-33 processing in dry eye”发表在国际知名眼科期刊The Ocular Surface(影响因子12.336)。
论文链接:https://www.sciencedirect.com/science/article/pii/S1542012420301087?via=ihub