
中大新闻网讯(通讯员 张玉琦)2025年12月18日,中山大学中山医学院李隽教授、广州医科大学刘金保教授与美国德克萨斯大学唐道林教授团队合作,在Molecular Cell上发表了题为Targeting PRDX6-dependent localization and function of GPX4 enhances ferroptosis-mediated tumor suppression的研究成果。该研究系统揭示了过氧化还原酶6(PRDX6)介导的铁死亡防御机制,阐明了其结合并携带GPX4蛋白上膜促进细胞膜磷脂过氧化损伤修复,进而诱导肿瘤细胞铁死亡逃逸的作用机制,为靶向癌症治疗提供了新思路。
为探究细胞应对铁死亡的脂质代谢重编程,研究者开展了脂质组学分析。结果显示,脂质过氧化刺激下细胞内溶血磷脂(尤其是LPC与LPE)水平显著升高,进而鉴定出关键作用的磷脂酶PRDX6。而敲低PRDX6会削弱过氧化应激下的溶血磷脂产生,并增强脂质过氧化反应及铁死亡。进一步研究显示,PRDX6还是GPX4在过氧化应激下靶向质膜的关键招募因子。细胞膜组分分离及免疫荧光实验显示,铁死亡诱导剂处理可促使PRDX6与GPX4共定位于质膜,而PRDX6敲低则阻断GPX4的膜转位。此过程依赖于PRDX6的C47位点介导的二硫键结合及其H26位点(与磷脂底物结合相关)的完整性。体外脂质体结合实验证实其功能意义:GPX4单体对中性磷脂(PC/PE)构成的氧化脂质体亲和力较弱,但PRDX6-GPX4异源二聚体能有效结合此类脂质体。相应地,PRDX6缺失特异性削弱了GPX4对过氧化PC和PE(PHGPx活性)的还原能力,但不影响其对带负电的过氧化PG/PI的活性。PRDX6-GPX4复合物通过“先还原后水解”的双酶级联反应,将过氧化磷脂转化为溶血磷脂和还原态脂肪酸,从而实现对细胞膜过氧化损伤的高效彻底修复。通过细胞系来源异种移植(CDX)和患者来源异种移植(PDX)模型证实了下调PRDX6可显著促进铁死亡诱导剂的抗肿瘤效应。
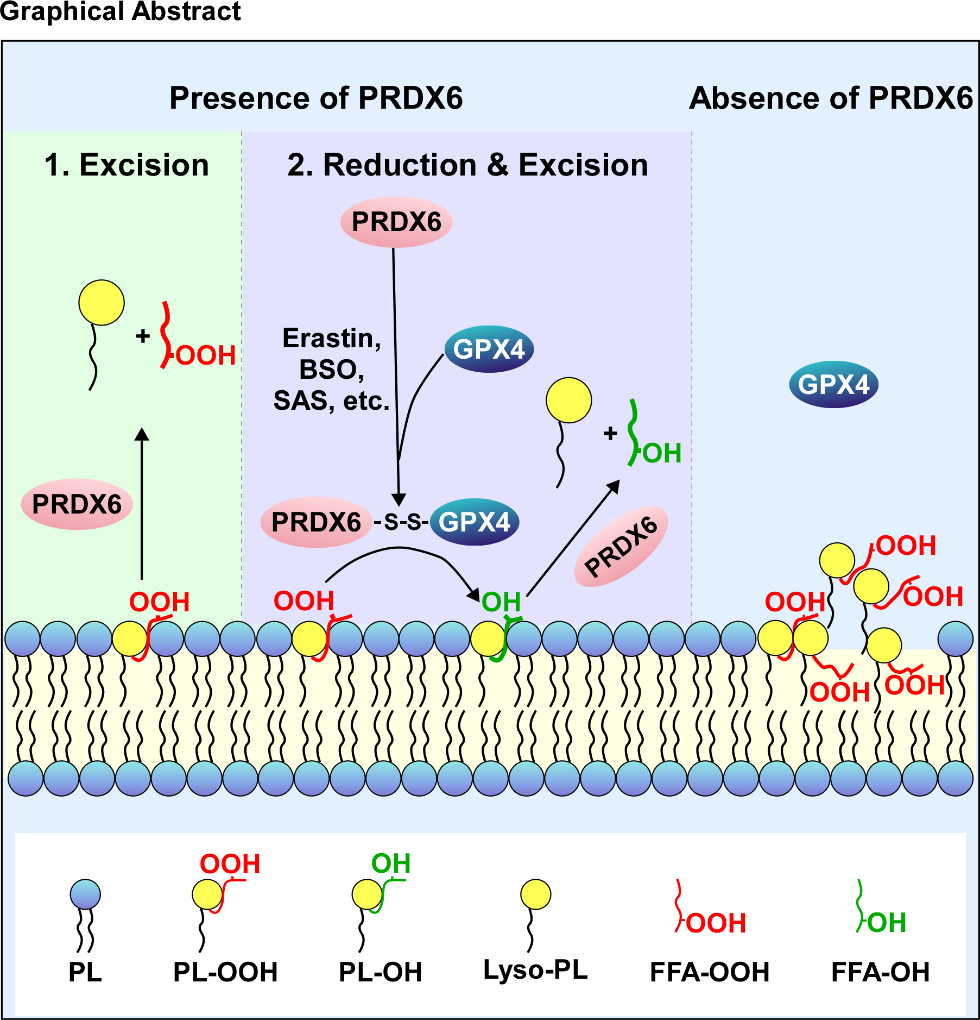
这项系统性研究阐明了PRDX6的关键枢纽作用:它不仅可通过二硫键与GPX4形成复合物,驱动其膜转位,还能通过磷脂酶活性协同完成对过氧化膜磷脂的序贯修复,从而赋予肿瘤细胞铁死亡抵抗能力。这一发现不仅揭示了肿瘤抗氧化防御的新机制,也为克服临床肿瘤铁死亡抵抗提供了潜在靶点。
广州医科大学基础医学院胡雅梦博士和中山大学附属第三医院博士后李梓文为本研究的共同第一作者。中山大学中山医学院李隽教授、广州医科大学刘金保教授与美国德克萨斯大学唐道林教授为论文的通讯作者。
原文链接:https://www.cell.com/molecular-cell/abstract/S1097-2765(25)00940-2