
中大新闻网讯(通讯员徐炳哲)2026 年 1 月 7 日,中山大学生物医学工程学院徐炳哲副教授团队在《自然・通讯》发表研究,其开发的集成微流控与多通道电极阵列的实时电生理监测系统,结合 LSTM 神经网络,首次实现对胶质瘤与神经元电信号交互的高分辨率动态解析与干预;。
研究团队搭建了一套微流控-电极阵列芯片系统,该系统可在神经元与胶质瘤细胞长达7天的共培养周期内,同步采集两类细胞的电生理活动数据,并实时追踪肿瘤细胞的侵袭路径。基于空间编码的信号指纹识别技术,该系统能够精准区分侵袭前沿、细胞混合区等不同区域的电信号特征模式;再结合 LSTM 神经网络对动态信号进行解码,平台可高效识别与肿瘤侵袭行为相关的特异性神经电活动,并完成信号类别的自动化分类。为探究神经电活动对胶质瘤侵袭的直接作用机制,研究人员开展了无神经元共培养的对照实验,直接采用活跃神经元的自发电信号刺激胶质瘤细胞。实验结果显示,这类信号虽能触发肿瘤细胞的钙瞬变反应,并轻微提升其迁移能力,但促侵袭效应远低于神经-肿瘤共培养体系下观察到的“超侵袭”现象,这说明单纯的神经电活动并不足以介导胶质瘤的高强度侵袭行为。
进一步研究证实,在共培养体系中,胶质瘤细胞并非被动响应神经电信号,而是主动“劫持”并重塑了周围神经的电活动:被改造后的神经电信号在频率、波形及上升/衰减时间等关键参数上均出现显著变化,其中γ波(30–100 Hz)与 θ波(4–8 Hz)的活动强度尤为突出。更关键的是,将这种“被劫持”的电信号模式单独作用于胶质瘤细胞时,即便脱离神经元共培养环境,也能诱导出与共培养状态相似的超侵袭效应。这一发现证实,胶质瘤细胞可通过改写神经电信号的编码模式,自主构建利于自身侵袭扩散的电生理微环境。该研究构建的平台解决了肿瘤电生理研究中信号来源模糊、相互作用难以实时解析的难题,为在时间和空间尺度上精确定位肿瘤与神经的电生理交互提供了强大工具。研究不仅深化了对脑胶质瘤侵袭机制的理解,也为靶向肿瘤-神经电生理互作的新型治疗策略(如靶向性神经调控)提供了重要的理论和实验依据
相关研究成果以“A Machine Learning-Driven Electrophysiological Platform for Real-Time Tumor-Neural Interaction Analysis and Modulation”发表于《自然·通讯》(Nature Communications)(doi.org/10.1038/s41467-025-66988-y )
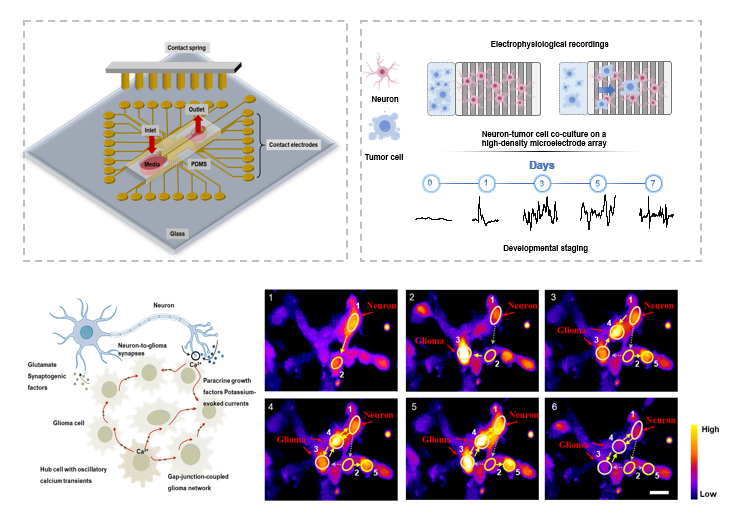
机器学习驱动的电生理平台用于实时肿瘤-神经相互作用分析与调控
论文链接:https://www.nature.com/articles/s41467-025-66988-y