
近日,我校附属第六医院吴小剑主任医师、王文宇副研究员联合新加坡基因组研究院于强教授团队在Nature Communications杂志在线发表了题为“Stromal induction of BRD4 phosphorylation Results in Chromatin Remodeling and BET inhibitor Resistance in Colorectal Cancer”的研究论文。该研究成果揭示了结直肠肿瘤微环境中的炎性因子IL-6/IL-8通过激活下游JAK2激酶,促进BRD4酪氨酸97/98位磷酸化,增强结直肠肿瘤对BET抑制剂的抵抗以及肿瘤恶性程度的表观遗传调控新机制,为联合靶向肿瘤微环境IL6/JAK2信号及BRD4治疗CRC的新策略提供了强有力的理论依据。
附属第六医院王文宇副研究员和新加坡基因组研究院Yen-An Tang博士为论文的共同第一作者;新加坡基因组研究院于强教授,附属第六医院吴小剑主任医师和王文宇副研究员为本文共同通讯作者。该研究得到国家自然科学基金、中山大学青年教师重点培育计划、广东省重点研发计划、广东省科技计划等项目的资助。
BET 家族蛋白,特别是 BRD4,作为重要的转录和表观遗传调节因子,与包含结直肠肿瘤在内的多种肿瘤进展密切相关,已成为科学家们开发癌症创新疗法的新兴靶点之一。目前已有多个小分子BET抑制剂(BETi,BET inhibitors)进入临床试验,虽然在血液肿瘤早期临床实验中BETi显示出令人鼓舞的效果,但在实体肿瘤中疗效却差强人意。
近年来,“肿瘤生态学说”逐渐成为科学家们试图攻克癌症的突破口,肿瘤微环境和肿瘤细胞被认为是滋生肿瘤的“土壤”和“种子”,肿瘤细胞和微环境中其他组分的频繁互动被认为是导致肿瘤进展、耐药的关键因素。
炎症微环境是肿瘤的十大特征之一,既往研究表明炎性因子可以通过激活关键促肿瘤信号通路或抑制抗肿瘤免疫应答而促进肿瘤发生发展,但关于炎性因子是否能够通过表观遗传调控(如染色体重塑)的方式参与调控肿瘤的相关生物学行为目前尚缺乏报道。
团队人员首先建立了患者来源的肿瘤细胞(patient-derived cancer cells, PDCs)及肿瘤相关成纤维细胞(cancer-associated fibroblasts,CAFs)共培养模型。进一步通过细胞因子、表观遗传因子筛选联合质谱分析等手段,鉴定出CAFs分泌的细胞因子IL-6/IL-8通过激活JAK2激酶通路,磷酸化BRD4,促进其与去泛素化酶UCHL3结合从而增强BRD4蛋白稳定性。此外,第97位酪氨酸(Y 97)是BRD4 与BET 抑制剂-JQ1 结合口袋中的关键残基,BRD4 Y97/98 的磷酸化削弱了 JQ1与BRD4的结合能力,导致 JQ1治疗抗性。更深入的探索发现 BRD4磷酸化还有助于其与 STAT3 的结合,诱导染色体重塑,协同促进原癌基因增强子活性及相关基因的转录。抑制 IL-6/IL-8-JAK2 信号能够消除 BRD4 磷酸化,增加BETi敏感性。
更重要的是,该团队利用来自附属第六医院临床结直肠肿瘤患者的组织芯片证实了CAFs-JAK2信号通路激活与BRD4磷酸化水平呈现显著正相关,并与病人的预后、肿瘤转移相关。同时,进一步研究利用肿瘤异种移植模型评估了IL-6/IL-8-JAK2-BRD4通路作为结直肠肿瘤治疗靶点的效果。实验结果显示,与单药相比,IL-6/IL-8通路抗体/抑制剂(Tocilizumab/Reparixin)或JAK2抑制剂Pacritinib与BETi联用对CAFs诱导的BETi抗性具有很好的抑制作用,显著抑制结直肠肿瘤生长。
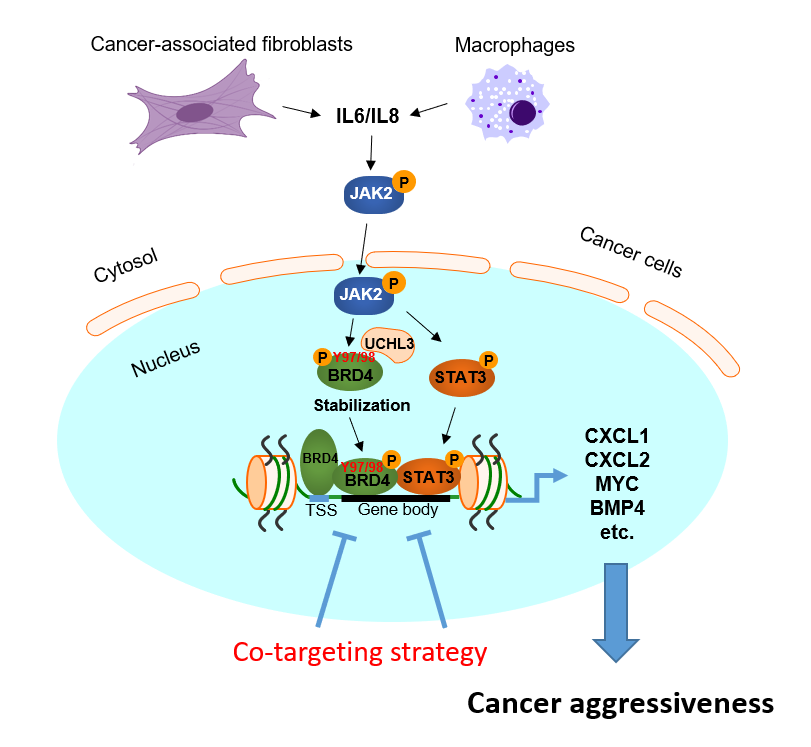
IL-6/8-JAK2-BRD4信号轴调控BET抑制剂耐药的模式示意图
该研究展示了肿瘤微环境通过“三管齐下”的方式导致BETi耐药的新机制,即增强BRD4蛋白稳定性;削弱其与BET抑制剂结合能力;诱导染色体重塑,促进原癌基因增强子活性,最终导致结直肠肿瘤对BETi的抵抗及肿瘤恶性程度增加。该发现强调了肿瘤微环境中的炎症信号通过染色体重塑的方式实现与肿瘤细胞的“对话”,为理解结直肠肿瘤的进展、耐药提供了新见解。研究提出的联合靶向IL-6/IL-8/JAK2 及其活化的 BRD4可成为临床转化的选择。评估 pJAK2、pBRD4 和 UCHL3 在 CRC 中的表达可能有助于指导患者选择合适的治疗策略,为结直肠肿瘤患者的治疗提供了新方向。