
肺癌是世界癌症死亡的主要原因,每年估计有160万人死亡。据估计,2015年中国肺癌发生病数为78.2万人,占新发癌症的20.65%,是我国第一大癌症,其中非小细胞肺癌(Non-Small Cell Lung Cancer, NSCLC)约占肺癌的85%。大多数晚期NSCLC患者仍采用常规化疗方案治疗,如铂类药物,但常常伴有耐药性。诱导免疫原性细胞死亡(Immunogenic Cell Death, ICD)被认为是一种很有前途的癌症免疫治疗策略。化疗药物诱导的ICD可作为一种新的治疗非小细胞肺癌方法,突破耐药屏障,刺激肿瘤特异性T细胞免疫应答,增强免疫治疗的抗肿瘤作用。
目前只有少数的化疗药物可以诱发ICD,而且多数为非金属化合物,金属ICD诱导剂研究目前集中于铂(IV)配合物,钌(II)配合物和铜(II)配合物等,主要诱导结肠癌、乳腺癌免疫原性细胞死亡。铱(III)配合物诱发肿瘤细胞产生ICD目前尚未见文献报道。
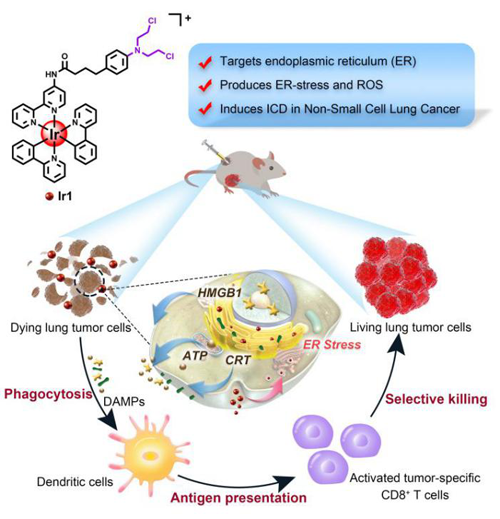
图1. 铱(III)配合物诱发非小细胞肺癌ICD的作用机理示意图
近日,我校化学学院巢晖教授研究团队报道了一例基于铱(III)配合物的非小细胞肺癌ICD诱导剂(Ir1)。 Ir1诱导肿瘤细胞产生ICD,释放损伤相关模式分子(DAMPs),最终激活T细胞相关的免疫应答。据悉,这是首例用于非小细胞肺癌的内质网靶向铱(III)配合物ICD诱导剂。
Ir1通过内吞途径有效靶向NSCLC细胞内质网,触发ROS的产生和内质网应激,以及线粒体膜电位(MMP)的丢失,导致严重的细胞内损伤。Ir1具有较高的细胞毒性,并在A549肺癌细胞和顺铂(CDDP)耐药株A549R细胞中诱导ICD的多个特征性标识,如钙网蛋白(CRT)的表面暴露、高迁移率蛋白(HMGB1)和ATP的胞外释放等。同时通过疫苗实验也证实,肿瘤细胞经Ir1处理后可以触发实验动物产生适应性免疫反应,激发了强烈的抗肿瘤免疫。因此,Ir1是一种具有ICD和化疗双重作用的抗肿瘤药物。
该研究成果发表在化学顶级期刊Angewandte Chemie International Edition,题目为“An ER‐Targeting Iridium(III) Complex which Induces Immunogenic Cell Death in Non‐Small Cell Lung Cancer”,并被评为VIP论文。文章的第一作者是我校博士研究生王丽丽,通讯作者为巢晖教授。
以上研究工作得到了国家自然科学基金(21525105,21778079,21907112),教育部(No.IRT-17R111)和中央高校基础研究经费(20lgjc01)等项目的资助。