
中大新闻网讯(通讯员谢国友)N1-甲基腺嘌呤(m1A)是RNA转录后的一种重要修饰,通过在腺苷酸的N1位添加甲基而形成。RNA m1A甲基化修饰被发现于19世纪60年代,过去认为m1A甲基化主要发生在rRNA和tRNA,参与RNA三级结构的维持并影响蛋白翻译效率。近年来,通过高通量测序技术,发现m1A修饰同样存在于mRNA。其可干扰Watson-Crick碱基配对原则,表明m1A修饰的重要调节作用。然而,目前对于mRNA m1A修饰的生物学功能研究尚处于起步阶段。
近日,中山大学药学院王红胜教授课题组在国际知名学术期刊《美国国家科学院院刊》(PNAS)以研究长文形式发表了题为“RNA m1A methylation regulates glycolysis of cancer cells through modulating ATP5D”的研究论文(direct submission),发现m1A可通过调控线粒体ATP合酶F1结构域中δ亚基的组成部分ATP5D的表达调控肿瘤细胞糖酵解水平。m1A通过介导形成YTHDF1/eRF1/mRNA复合物抑制ATP5D的翻译,同时通过调控转录因子E2F1的表达负向调控ATP5D mRNA的稳定性。利用dm1ACRISPR系统靶向去除ATP5D m1A修饰则上调ATP5D表达,从而引起肿瘤细胞糖酵解水平升高。这些结果揭示了mRNA m1A修饰与肿瘤代谢之间的调控关系,为肿瘤的治疗提供了潜在的干预策略。
能量代谢是细胞生命活动的基本特征之一,细胞能量代谢的重编程在肿瘤相关研究中日益受到关注。能量代谢作为肿瘤细胞的重要标志,Warburg效应指出不管氧气是否存在,癌细胞都能最大限度依赖糖酵解来获取能量。该团队首先使用CRISPR/Cas9基因编辑技术及shRNA敲低m1A去甲化酶ALKBH3以构建m1A高水平肿瘤细胞模型,发现ALKBH3敲低肿瘤细胞葡萄糖消耗、乳酸生成、ATP水平及胞外酸化率(ECAR)显著降低,进一步转染ALKBH3 m1A去甲基化酶活性位点突变质粒A3-R122S、A3-L177A确认了以上生物学效应由m1A介导,以上结果说明m1A参与调控肿瘤细胞能量代谢。
为了探讨m1A调控肿瘤细胞能量代谢机制,该课题组通过mRNA-seq、m1A-seq及前期报道的m1A修饰的mRNA,发现m1A可能是通过调控关键基因ATP5D的表达介导肿瘤细胞能量代谢,ATP5D是线粒体ATP合酶F1结构域中δ亚基的组成部分,通过耦合质子转运催化ATP的合成。m1A-qPCR及ATP5D补救实验确认了ATP5D在m1A调控肿瘤细胞能量代谢的关键作用,同时发现m1A在转录及翻译层面调控ATP5D mRNA的生物学行为。利用ChIPBase、PROMO及JASPAR转录因子预测在线数据库、启动子荧光素酶报告基因系统、ChIP-qPCR及点突变实验发现m1A调控表达的转录因子E2F1通过结合ATP5D启动子-30~-23区域调控ATP5D的转录。
进一步,该课题组利用Co-IP、CLIP-PCR及Ribo-seq实验鉴定出ATP5D m1A的识别效应蛋白为YTHDF1,它通过招募真核生物翻译终止因子eRF1形成YTHDF1/eRF1复合物增强翻译终止效率,从而抑制ATP5D的翻译。为解析m1A抑制ATP5D mRNA翻译的具体修饰位点,RNA fragmentation及m1A-qPCR首先鉴定出ATP5D的m1A修饰位点位于其CDS区域的1号外显子上(Exon1)。课题组结合ATP5D Exon1的结构特点,将其中附近CG含量高的A(A53、A71、A105/106/109/111、A136)进行突变,发现m1A-71可能为调控ATP5D mRNA 翻译的关键性修饰位点。随后利用选择性去除m1A甲基化修饰工具dm1ACRISPR擦除A71的m1A,结果显示ATP5D翻译效率显著升高,YTHDF1与eRF1之间的结合减少且肿瘤细胞葡糖糖消耗、乳酸生成及ATP生成增加,提示ATP5D Exon1区域的m1A-71是m1A调控ATP5D mRNA翻译及介导肿瘤细胞能量代谢过程的关键甲基化位点。
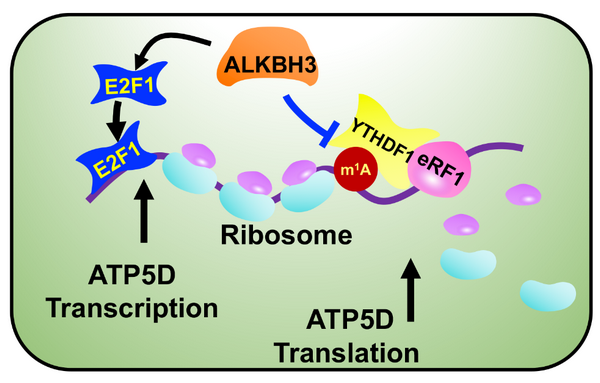
图1. m1A调控ATP5D转录及翻译分子机制模式图
研究进一步探讨体内外m1A/ATP5D对肿瘤进展的影响,发现敲低ALKBH3细胞的增殖、迁移、侵袭能力显著降低及对阿霉素(DOX)、顺铂(CDDP)等化疗药物的敏感性降低。当在细胞中过表达ATP5D,上述效应则被逆转。体内实验表明敲低ALKBH3则显著抑制肿瘤的生长,以及降低肿瘤组织中ATP5D的表达,但ATP5D过表达可有效逆转上述作用。临床分析发现,相较于癌旁组织,ALKBH3及ATP5D在癌组织中表达显著升高,且在癌组织中二者表达水平呈正相关关系(P=0.044),ALKBH3或ATP5D表达水平高的患者有着更差的总生存期。
本研究深入解析了m1A调控ATP5D转录及翻译的表观遗传机制,揭示了mRNA m1A修饰与肿瘤细胞能量代谢之间的调控关系,拓宽了对m1A调控mRNA生物学行为相关研究的认知,并为基于mRNA m1A修饰肿瘤干预策略提供了理论依据及作用靶点。吴映敏、陈卓佳、谢国友为论文共同第一作者,王红胜为论文独立通讯作者。上述研究工作获得国家自然科学基金等多项基金的资助及中山大学附属肿瘤医院陈丽昆教授、南方医科大学珠江医院牛红心教授、北京大学伊成器教授等课题组的支持和帮助。
论文链接:https://www.pnas.org/eprint/GQPCDX5DEPHAME33MKXF/full