
中大新闻网讯(通讯员黄怀义)肿瘤是当前危害人类社会的重大健康问题,开发高效、低毒的抗肿瘤药物具有重要的研究意义和社会价值。乏氧微环境是实体肿瘤的显著特征,导致临床肿瘤难以根治、容易复发和转移。研究治疗乏氧肿瘤的新型抗肿瘤药物及其作用机制,具有重大的理论及临床应用价值。
近三年,中山大学药学院(深圳)黄怀义副教授研究团队在金属光敏剂的构效优化、光动力治疗新机制、体内和体外抗肿瘤活性研究方面做了系统性和开创性的研究工作,取得了阶段性的研究成果,这些前期开展的工作紧密结合药物研发领域面临的重大问题和挑战,具有重要的基础研究价值和潜在的应用前景。
首先,团队首次提出乏氧肿瘤光催化治疗理论。线粒体呼吸链是能够感受氧气浓度变化的敏感细胞器,并通过线粒体呼吸链调控乏氧诱导因子的表达以促进肿瘤适应乏氧环境。通过设计线粒体靶向金属光敏剂,利用铱光敏剂的微秒级长激发态寿命和激发态高氧化还原电位,基于低耗氧的光致电子转移机制,在常氧和乏氧环境下均实现对线粒体呼吸链电子供体,还原态烟酰胺腺嘌呤二核苷酸(NADH)的高效光催化氧化,进而破坏线粒体电子传递链正常生理功能,肿瘤乏氧诱导因子的无法顺利表达,肿瘤细胞内氧化还原失衡并诱导肿瘤免疫原性细胞死亡(图1)。这项研究为开发治疗乏氧肿瘤的新型光敏剂,提供了新概念和新方法,该成果以“Targeted photoredox catalysis in cancer cells”为题发表于化学顶级期刊Nature Chemistry(2019,11,1041,IF = 24.4,SCI高被引论文),中山大学药学院(深圳)黄怀义副教授和印度理工学院Samya Banerjee助理教授为论文的共同第一作者,英国华威大学Peter Sadler教授、法国巴黎文理研究大学Gilles Gasser教授和中山大学化学学院巢晖教授为论文的共同通讯作者,中山大学为该成果第一完成单位。
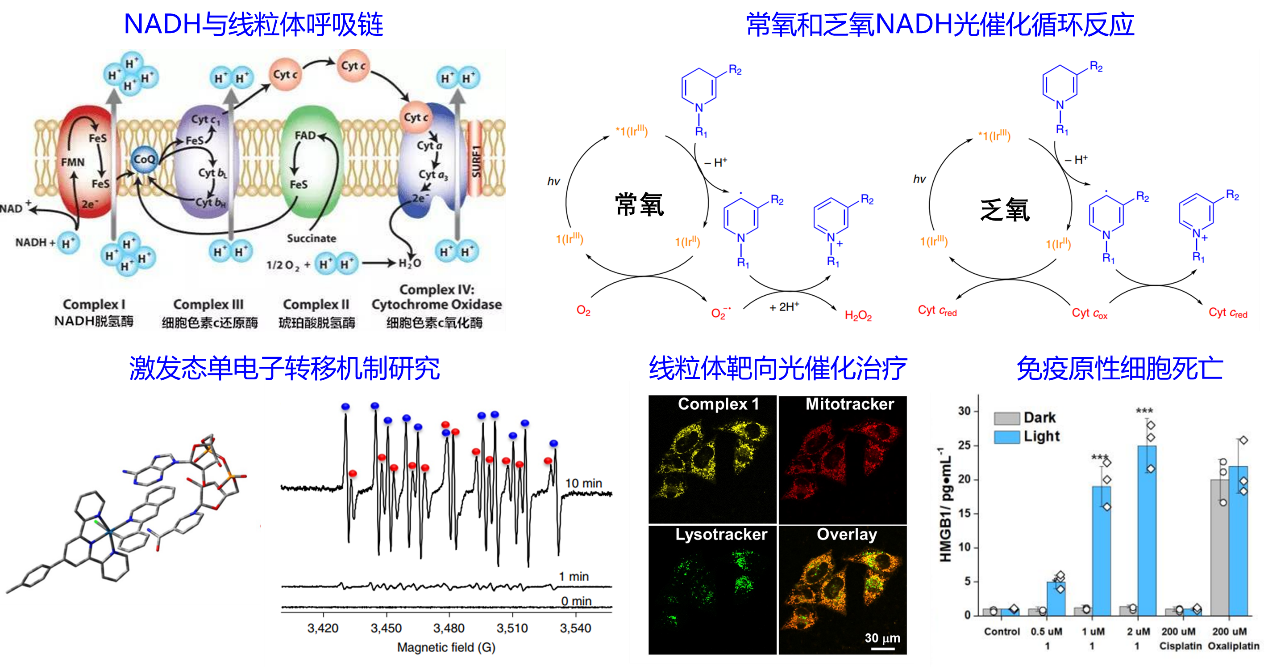
图1. 乏氧肿瘤线粒体靶向铱光敏剂用于NADH光催化氧化治疗
传统的铱光敏剂在可见光区域吸收性能较差、脂溶性高、线粒体靶向性强导致细胞暗毒性高等缺陷。团队通过系统的构效关系研究,创新性地引入具有强光吸收性能的香豆素基团和水溶性的季铵盐基团,获得光吸收性能优异、靶向肿瘤细胞溶酶体的新型铱光敏剂,具有极低的细胞暗毒性和优异的生物相容性,对体外培养的耐索拉非尼肝癌细胞和皮下荷瘤小鼠均表现出良好的光催化治疗活性。这项工作为设计和开发高效、低毒的金属光敏剂的提供了新的研究思路(图2)。这项研究成果以“In-vitro and In-vivo Photocatalytic Cancer Therapy with Biocompatible Iridium(III) Photocatalysts”为题发表于化学顶级刊物Angewandte Chemie International Edition (2021,60,9474,热点论文,IF = 15.3)。中山大学药学院(深圳)研究生黄灿为论文的第一作者,黄怀义副教授为论文唯一通讯作者,中山大学为该成果第一完成单位。
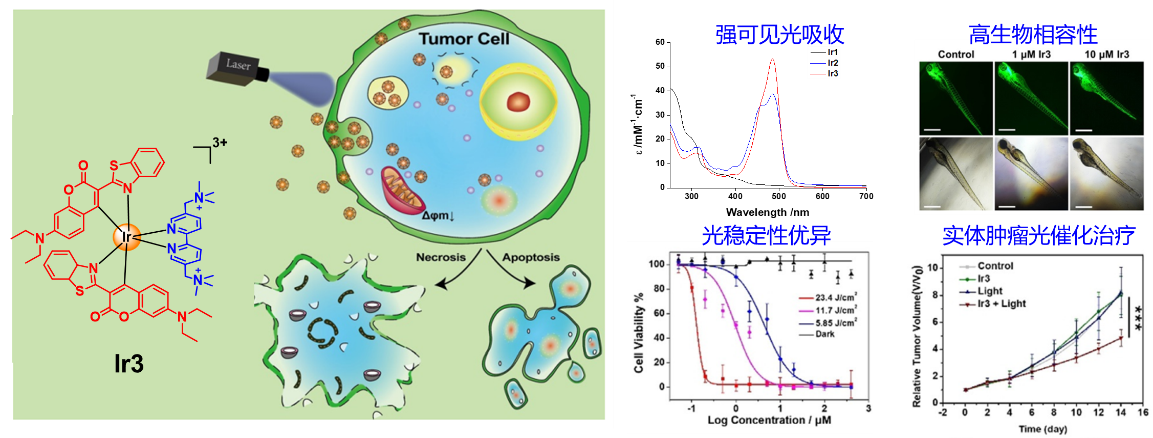
图2. 强光吸收、高生物相容性铱光敏剂用于肿瘤光催化治疗
肿瘤异质性与多药耐药性是临床肿瘤治疗的难点,是导致临床肿瘤治疗失败和复发的重要原因。近日,该团队首次在单细胞层次探究了克服肿瘤异质性的金属药物设计策略。基于单细胞电感耦合等离子体质谱(ICP-MS)技术,研究发现相比单核铱配合物,双核铱配合物的细胞摄取和胞内滞留效率显著提高。此外,双核铱配合物的激发波长显著红移、三重激发态寿命延长、NADH光催化性显著增强,在525纳米绿光照射下,表现出良好的肿瘤光催化治疗活性(图3)。这项工作开创性地在单细胞层面揭示多核金属配合物在克服肿瘤异质性和多药耐药性问题的显著优势,对开发治疗耐药性肿瘤的新型金属配合物提供了新的理论和研究实践。近日,该成果以“Single-Cell Quantification of a Highly Biocompatible Dinuclear Iridium(III) Complex for Photocatalytic Cancer Therapy”为题发表于化学顶级刊物Angewandte Chemie International Edition(2022,DOI: 10.1002/anie.202202098,IF = 15.3)。中山大学药学院(深圳)研究生范中贤为论文的第一作者,黄怀义副教授和印度理工学院Samya Banerjee助理教授为论文共同通讯作者,中山大学为该成果第一完成单位。
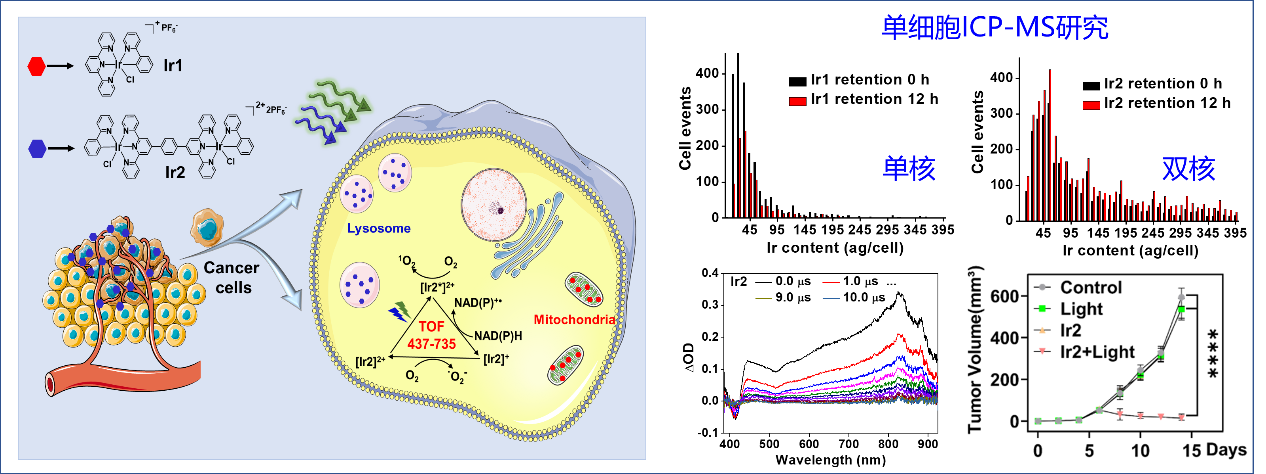
图3. 双核铱配合物用于克服肿瘤异质性和肿瘤光催化治疗
基于团队在肿瘤光治疗领域的研究贡献,黄怀义副教授受邀以通讯作者身份撰写光活化金属抗肿瘤药物研究进展的综述论文,以“New Designs for Phototherapeutic Transition Metal Complexes”为题发表于化学顶级刊物Angewandte Chemie International Edition(2020,59,61,IF = 15.3,高被引论文),中山大学为论文第二完成单位。此外,黄怀义副教授以通讯作者身份撰写细胞器靶向金属配合物的综述论文,以“Recent advances in endoplasmic reticulum targeting metal complexes”为题发表于化学顶级综述期刊Coordination Chemistry Reviews (2020,408,213178,IF = 22.3),中山大学药学院(深圳)研究生黄灿为论文的第一作者,中山大学为论文第一完成单位。
项目团队依托中山大学药学院(深圳)建立先进的高通量光敏化药物筛选平台,致力于发现肿瘤光催化治疗和肿瘤靶向药物递送的新方法和新机制,并基于多组学平台开展肿瘤光催化治疗的机制研究。同时,团队也正开展氘代金属药物和人源外泌体药物递送载体制备和应用研究。
相关论文链接:
1. https://www.nature.com/articles/s41557-019-0328-4
2. https://onlinelibrary.wiley.com/doi/abs/10.1002/ange.202015671
3. https://onlinelibrary.wiley.com/doi/abs/10.1002/anie.202202098
4. https://onlinelibrary.wiley.com/doi/10.1002/anie.201905171
5. https://www.sciencedirect.com/science/article/abs/pii/S0010854519305478