
中大新闻网讯(通讯员李剑峰)植物在生境中会不断受到病原菌的侵害,其中真菌病害造成约30%的作物损失。加强植物自身免疫是对抗各种病害最高效和环保的手段,而充分了解植物免疫信号转导和调控机制是改良植物抗病性的基础。植物主要依赖模式触发式免疫(PTI)和效应子触发式免疫(ETI)对抗病原菌。PTI基于植物细胞膜免疫受体对病原菌保守的标志性分子(如真菌细胞壁组分几丁质)的识别,能够赋予植物对病原菌大类(如真菌)广谱和基础的抗性。ETI基于植物细胞内的TIR-NLR和CC-NLR两类免疫受体对病原菌分泌的效应蛋白或其破坏作用的感知,能够激活植物对携带该效应蛋白的病原菌小种更强烈和特异的抗性。PTI和ETI并非相互独立,而是互相促进的过程。植物特有的类脂酶蛋白EDS1是ETI中TIR-NLR下游信号转导的关键分子,同时eds1缺失突变体中PTI也会发生缺陷。然而,EDS1如何参与PTI大体未知。
近日,中山大学生命科学学院李剑峰课题组揭示了模式植物拟南芥中细胞膜定位的类受体胞质激酶(RLCK)PBL19,受真菌几丁质信号诱导迁移至细胞核,经过转录放大和细胞质中的蛋白加工,最后磷酸化EDS1,从而增强植物真菌抗性的一条新型免疫信号通路。
目前已知拟南芥RLCK VII-4亚家族(包括PBL19、PBL20等成员)主要介导了几丁质共受体CERK1下游的免疫信号转导。作者首先发现PBL19的N端具有棕榈酰化位点(Cys3)和一段核定位信号(NLS),而其同源蛋白PBL20则没有NLS。PBL19在几丁质诱导下能够部分迁移入核。有趣的是,棕榈酰化缺失突变导致持续定位于细胞核的PBL19C3A变体会引发植物的组成型免疫,且该过程依赖于PBL19入核后通过招募转录因子WRKY8实现的自身转录上调。PBL19持续入核还会导致植物抗病激素水杨酸(SA)的过度积累。然而,组成型免疫植株与eds1缺失突变体杂交能够完全抑制SA的积累和组成型免疫表型,表明EDS1位于PBL19入核免疫通路的下游。由此,推测PBL19与EDS1在细胞核内互作,却意外发现PBL19与EDS1在细胞质中的点状结构上互作。随后,发现与EDS1互作的是被细胞质蛋白酶MC4切除N端棕榈酰化位点和NLS的截短型PBL19(ntPBL19),而并非全长的PBL19。最后,发现几丁质能够诱导ntPBL19在体内磷酸化EDS1,并导致EDS1在细胞质中积累。PBL19也能在体外磷酸化EDS1,而模拟持续磷酸化的EDS1变体能够补偿PBL19基因缺失造成的植物真菌易感表型。综上,该研究揭示了细胞膜、细胞核和细胞质定位的PBL19依次扮演信号传感器、放大器和效应器的角色,从而介导的一条几丁质信号转导新通路,并首次报道了EDS1磷酸化在植物免疫调控中的功能。
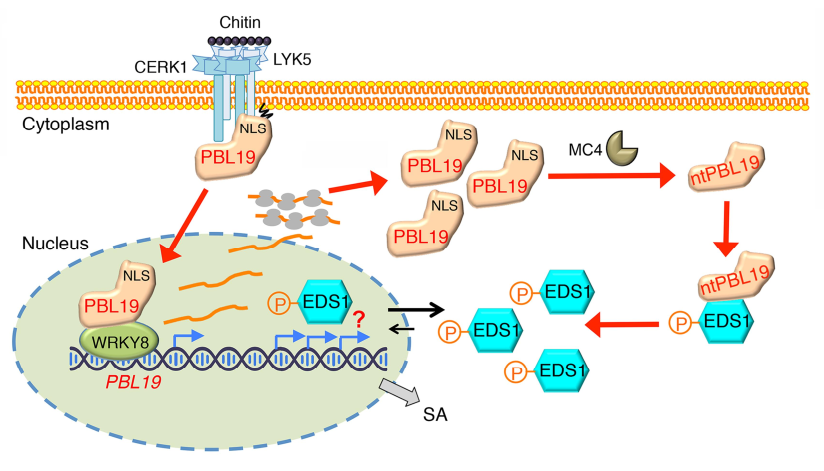
图1:植物免疫信号转导新通路
近期,两篇背靠背的Nature论文表明EDS1参与了植物PTI中LRR型细胞膜免疫受体RLP23下游的免疫信号转导,而该工作表明EDS1同样参与了PTI中LysM型细胞膜免疫受体CERK1下游的免疫信号转导。这些发现共同提示EDS1是PTI中多种细胞膜免疫受体下游共同的信号转导枢纽,并暗示EDS1可能是连接PTI和ETI并介导两者协同调控的关键分子之一。
该研究论文“Plasma membrane-nucleo-cytoplasmic coordination of a receptor-like cytoplasmic kinase promotes EDS1-dependent plant immunity”近期发表在Nature Plants期刊上,中山大学博士生李雨佳和已毕业的薛皦博士分别为该论文的第一作者和共同第一作者,李剑峰教授为通讯作者。该研究得到国家自然科学基金面上项目等资助。
论文链接:https://www.nature.com/articles/s41477-022-01195-x