
中大新闻网讯(通讯员王小厂)创伤后应激障碍(post-traumatic stress disorder, PTSD)是个体在经历重大威胁性事件或严重精神创伤而出现的应激相关障碍,是精神刺激所致精神损伤的典型代表。随着经济社会的发展,精神损伤相关案件日益增多,诉讼双方对伤病关系、损伤因素参与度等鉴定意见经常存在质疑。由于PTSD的发病机制仍不清楚,鉴定技术缺少客观的生物学指标,同时还可能受到诈病的影响,精神损伤相关司法鉴定仍是法医学的难题。
恐惧记忆的过度泛化是PTSD 核心症状的发生基础,让个体不能有效地预测威胁,还将中性甚至安全线索均视为危险信号,导致时时“杯弓蛇影”、处处“草木皆兵”。目前恐惧记忆泛化的发生机制仍然不清楚。近日,中山大学法医鉴定中心赵虎教授科研团队从TET-3介导的DNA去甲基化的角度,阐释了应激诱导恐惧记忆泛化的表观遗传机制,在知名期刊 Brain Pathology(中科院期刊分区 医学 1区)发表题为“Deficiency of Tet3 in nucleus accumbens enhances fear generalization and anxiety-like behaviors in mice”的研究论文。
该工作揭示了大脑神经元TET 家族最丰富的 DNA 去甲基化酶TET3,可感知外在环境应激,并将神经可塑性与恐惧泛化过程中的行为适应联系起来。他们发现足部电击强度依赖性地诱导小鼠恐惧泛化和伏隔核 (NAc) 的TET3 表达,而对TET1和TET2的表达没有影响。通过在 NAc灌注抑制剂或 AAV-Tet3-shRNA 病毒来抑制 DNA 去甲基化可增强恐惧泛化和焦虑样行为。值得关注的是,TET3的下调使温和应激下本应形成特异性恐惧记忆转向泛化,提示TET3介导的去甲基化调控了PTSD的易感性。TET3 下调可损害神经元结构可塑性,降低 DNA 羟甲基化 (5hmC),降低突触可塑性相关基因Homer1等的表达,有趣的是,免疫相关基因 B2m等的表达却增加。进一步研究发现,下调TET3激活小胶质细胞和 CD39-P2Y12R 信号通路,而抑制 CD39可逆转 TET3 敲低对恐惧泛化和焦虑的影响。最后,通过CRISPR-Cas9过表达 TET3 可逆转恐惧泛化和焦虑样行为。
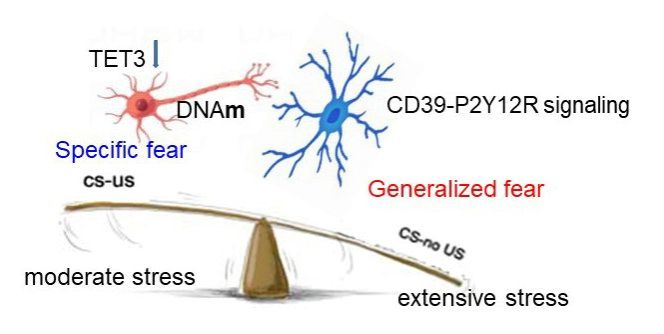
TET-3介导的DNA去甲基化表观遗传机制调控恐惧记忆泛化
该工作揭示了TET-3介导的表观遗传机制将个体经历和创伤暴露融入个体的遗传背景,以引发一系列不同的恐惧反应。中山医学院范卜方博士及郝博博士为论文的共同第一作者。王小广副教授及赵虎教授为论文的共同通讯作者。该工作是在国家自然科学基金重点项目和广东省自然科学基金重点项目等资助下,在近年来一系列研究发现的基础上取得的最新进展。
论文链接:https://doi.org/10.1111/bpa.13080