
5月26日,中山大学肿瘤防治中心高嵩教授课题组在《Nature Communications》杂志上发表题为“Conformational Dynamics of Dynamin-like MxA Revealed by Single-molecule FRET” (文章链接:https://www.nature.com/articles/ncomms15744)的研究论文,报道了人类抗病毒蛋白MxA在作用过程中构象变化的情况,进一步明确了MxA的抗病毒作用机制。陈洋博士(2016年毕业于我校)为第一作者,高嵩教授为通讯作者。
MxA蛋白是人类先天免疫系统的重要效应蛋白,对多种RNA病毒有强烈的抵抗作用。MxA属于dynamin蛋白家族,是一个含多个结构域的大型GTP酶。dynamin家族蛋白的功能依赖于自身多聚体的形成和解聚,其聚合状态的改变主要是通过GTP水解过程中产生分子内部的构象变化来实现的。在水解GTP的过程中,MxA大致存在四种状态,即游离态、GTP结合态、催化间态和GDP结合态。在以往的研究中,研究团队通过结构生物学及相关的生物物理和生化手段解析了MxA茎部和游离态全长的晶体结构(Nature 2010, 465:502-6;Immunity 2011, 35:514-25),了解了MxA蛋白多聚的分子机理。然而全长MxA在其他状态下的晶体结构一直尚未被解析,所以GTP水解对MxA分子构象变化的具体影响仍不十分明确。另一方面,MxA通过茎部形成多聚体的倾向造成其在非游离态的其他状态下容易形成不规则的聚集体,是对其进行结构研究时面临的最大困难。
高嵩教授课题组对MxA蛋白进行了多种修饰改造,经过不断探索尝试后成功获得了功能基本不受影响的MxA蛋白单体,并利用X射线晶体衍射技术解析了单体MxA晶体结构。此后,高嵩课题组与中科院生物物理所赵永芳教授课题组合作,根据结构巧妙设计了一系列单分子荧光共振能量转移的实验,最终通过这种技术含量极高的生物物理技术在单分子水平上揭示了MxA蛋白在GTP水解过程中实时的构象变化情况。该研究阐明了MxA蛋白在抗病毒作用过程中结构改变的动态过程,有助于全面了解MxA抗病毒的具体分子机制,并对人们了解其他dynamin家族成员的具体作用方式有重要的启发意义。
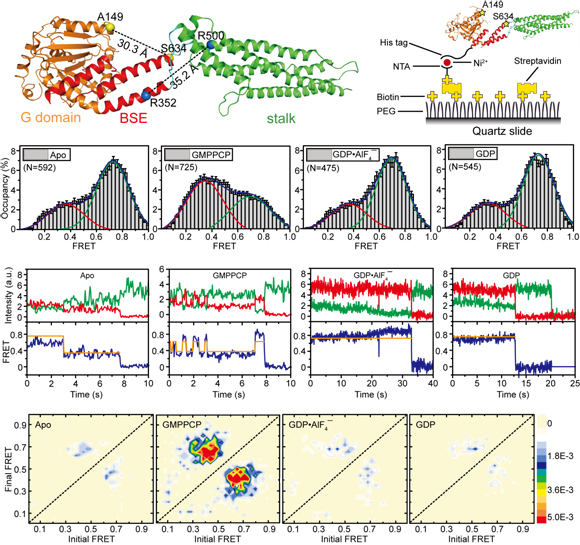
MxA单体的晶体结构和单分子构象动态变化
该研究工作的第一作者为陈洋博士和中科院生物物理所张磊博士。通讯作者是高嵩教授和中科院生物物理所赵永芳教授。德国弗莱堡大学的Kochs Georg教授和Graf Laura参与了该研究项目。X射线晶体衍射实验是在上海光源完成的。项目获得了国家自然科学基金、科技部973计划、广东特支计划,以及华南肿瘤学国家重点实验室等基金和单位的支持。