
中大新闻网讯(通讯员林园)溶瘤病毒M1 (oncolytic virus M1, OVM)是从中国海南岛库蚊属蚊虫中分离得到的包膜正链RNA甲病毒,是一种新型的溶瘤病毒(oncolytic virus, OV)。由于OVM具有良好的安全性和溶瘤作用,其I期临床试验已在日本获得批准,用于治疗晚期实体瘤。不久前,美国FDA也批准其作为治疗肝癌和恶性胶质瘤的罕见药。溶瘤病毒(OV)代表的是新兴的实体瘤多模式治疗方式。它们表现出肿瘤选择性溶瘤效应、免疫原活性以及能将靶向转基因递送至肿瘤。然而,患者从OV治疗中获益不同的事实带来提示,即使是相同的组织学类型,肿瘤异质性也可能导致患者对OV产生不同的效应。因此,开发能够在 OV 治疗前区分应答者和非应答者的预测性生物标志物非常重要。
近日,中山大学颜光美/张勤奋/林园团队在Oncogene上发表题为“STT3A-mediated viral N-glycosylation underlies the tumor selectivity of oncolytic virus M1”的论文。该研究发现肿瘤细胞中表达的STT3A调控溶瘤病毒M1包膜蛋白的N-糖基化修饰,进而影响了M1与受体的结合并最终决定着溶瘤病毒M1在肿瘤中的选择性与溶瘤效应。
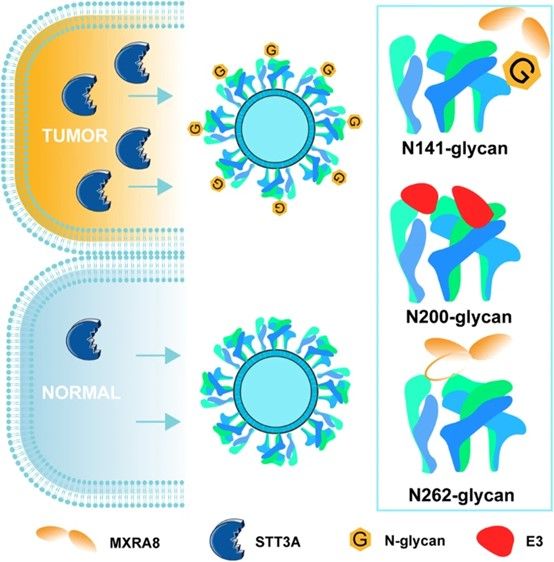
该团队在先前的研究中已经鉴定基质重塑相关蛋白8(matrix remodeling associated 8, MXRA 8)是OVM的受体,并且将MXRA 8设定为指示OVM高效溶瘤的生物标志物之一。然而,考虑到病毒蛋白的翻译后修饰可能会影响病毒与受体的结合,作者进一步对OVM上N-糖基的结构与功能展开了研究,以阐明OVM对肿瘤细胞选择性的机制。
研究示意图
作者首先通过单颗粒冷冻电镜 (cryo-EM)发现了OVM的包膜蛋白存在3个N-糖基化位点,分别是:E1-N141、E2-N200和E2-N262。接着,作者通过细胞和分子生物学实验证明OVM 上的 N-糖基通过不同的机制参与到与MXRA8 受体结合过程,并决定了OVM的溶瘤效应。
为了探究细胞的聚糖加工酶在OVM诱导的溶瘤过程中的作用,该研究进行了影响N-糖蛋白生物合成酶的小分子抑制剂筛选实验。结果发现寡糖转移酶 (OST) 抑制剂NGI-1对OVM上的包膜蛋白E1和E2的N-糖基化阻断作用最强,而NGl-1 已被证明可以抑制 OST 复合物的催化亚基 STT3A 和 STT3B。进一步地,通过siRNA敲低实验确认,只有用STT3A而非STT3B siRNA处理的细胞表现出OVM感染减少,且在肿瘤细胞上过表达STT3A,能够显著提高OVM的感染。与此同时,作者通过泛癌分析和组织芯片发现STT3A在多种人类癌症中显著上调,且在肿瘤组织和正常组织间的表达存在差异。这些结果不仅解释了为什么OVs对肿瘤细胞具有良好的靶向能力,还提示我们STT3A的个体差异可决定患者接受OVM治疗的疗效,治疗前可能需要进行STT3A的表达水平检测。
本研究揭示了 N-糖基化在 OVM 溶瘤中的作用,并在 STT3A 和 OVM 肿瘤选择性之间建立了联系,为设计OVM的精准治疗方案和开发新型生物标志物开辟了一条新的道路。
中山大学中山医学院博士研究生宋德力、生命科学学院博士研究生贾旭东为本文的共同第一作者。中山大学中山医学院林园副教授、生命科学学院张勤奋副教授为该研究论文的共同通讯作者。